(17分)二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)
(2)已知在一定温度下,以下三个反应的平衡常数为k1、k2、k3:
(3)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解100mL 1mo1 的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的负极反应式为_____________。
②电解后溶液的PH=_________________________
(4)工业合成氨的反应为: mol-1
mol-1
已知合成氨反应在某温度下2L的密闭绝热容器中进行,测得数据如下表:
根据表中数据计算:
①0 min~1 min内N2的平均反应速率为_________
②该条件下反应的平衡常数k=________(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,
化学平衡向_______(填“正向”、“逆向”或“不移动”),该反应的平衡常数k___________(填“变大”“减小”或“不变”)
(5)常温下,将0.2mol HCOOH和0.1mol
HCOOH和0.1mol NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。
NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。
该溶液中[HCOOH]-[OH-]+[H+]=______mol
(I)下列装置能组成原电池的是(填序号)
(II)将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)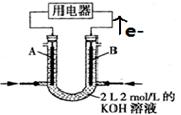
①(填A或B)处电极入口通甲烷,其电极反应式为;
②当消耗甲烷的体积为11.2 L(标准状况下)时,则导线中转移电子数为,消耗KOH的物质的量为。
有以下物质:①Ne;②NH4Cl;③KNO3;④NaOH;⑤Cl2;⑥SO2;⑦H2S;⑧Na2O2;⑨MgCl2。请用上述物质的数字序号填空:
(1)只存在离子键的是
(2)既存在离子键又存在极性键的是
(3)不存在化学键的是
(4)属于共价化合物的是
(12分)有机物C的分子式为C9H9OCl,分子中有一个苯环且苯环上只有一条侧链,无甲基;一定条件下C能发生银镜反应。C与其他物质之间的转化如下图所示: 
(1)F中官能团的名称是;C→F的反应类型是。
(2)C的结构简式是,I的结构简式是,
(3)写出下列化学方程式:D与银氨溶液反应___________。
(4)有的同学认为B中可能没有氯原子,理由是_____________。
(5)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有________种,写出其中核磁共振氢谱有4个峰且能发生银镜反应的结构简式____________。
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应
常温下,如果取0.1mol·L-1HCl溶液与0.1mol·L-1MOH溶液等体积混合(不计混合后溶液体积的变化),测得混合液的pH=5,请回答下列问题:
(1)混合后溶液的pH=5的原因(用离子方程式表示):
(2)混合溶液中由水电离出的H+浓度是0.1mol·L-1HCl溶液中由水电离出的H+浓度的倍。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
C(Cl-)-c(M+)=mol·L-1,c(H+)-c(MOH)=mol·L-1。
(4)已知CH3COOM溶液为中性,HF常温下电离常数为6.8×10-4,CH3COOH电离常为1.7×10-5。
则MF溶液的pH7(填<、>、=);将同温下等物质的量浓度的四种盐溶液:
| A.MHCO3 | B.CH3COOM | C.MClO | D.MCl |
按pH由小到大的顺序排列:(填序号)。
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如图所示:
①该反应正向属于________反应;(填“吸热”或放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时CH3OH体积分数为。
③在温度和容积不变的情况下,向平衡体系中再充入4molCO,8molH2,达到平衡时CO转化率_______(填“增大”,“不变”或“减小”), 平衡常数K_______(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+ H2O(g)= CO(g)+3H2(g) △H="+206.2" kJ·mol-1
CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H="+247.4" kJ·mol-1
则CO和H2O(g)反应生成CO2和H2的热化学方程式为:。
(3)CO还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时,负极的电极反应式为_______________________________。