下表是在相同温度下,三种酸的一些数据,下列说法正确的是
| A.相同温度下,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且K1>K2>K3=0.1 |
| B.室温时,若在NaZ溶液中加水,则c(Z-)/[c(HZ)×c(OH-)]的比值变小,若加少量盐酸,则比值变大 |
| C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-) |
| D.相同温度下,K5>K4>K3 |
常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中的关系
| A.c(NH4+)<c(Cl-) | B.c(NH4+)=c(Cl-) |
| C.c(NH4+)>c(Cl-) | D.无法确定c(NH4+)与c(Cl-) |
设C+CO2 2CO-Q1(吸热反应)反应速率为u1,N2+3H2
2CO-Q1(吸热反应)反应速率为u1,N2+3H2 2NH3+Q2(放热反应)反应速率为u2,对于上述反应,当温度升高时,u1和u2的变化情况为
2NH3+Q2(放热反应)反应速率为u2,对于上述反应,当温度升高时,u1和u2的变化情况为
| A.同时增大 | B.同时减小 | C.增大,减小 | D.减小,增大 |
可以充分说明反应P(g)+Q(g)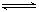 R(g)+S(g)在恒温下已达到平衡的是
R(g)+S(g)在恒温下已达到平衡的是
| A.反应容器内的压强不随时间改变 | B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 | D.反应容器内的气体总物质的量不随时间变化 |
下表中,对陈述I、II的正确性及两者间有无因果关系的判断都正确的是
| 选项 |
陈述I |
陈述II |
判断 |
| A |
用锌和足量稀硫酸制取氢气时加入硫酸铜溶液 |
可以制取更多的氢气 |
I对、II对、有 |
| B |
用Mg—Al—NaOH构成原电池 |
Mg更活泼作负极 |
I对、II对、无 |
| C |
AlCl3是离子化合物 |
电解熔融的AlCl3制取金属铝 |
I对、II对、无 |
| D |
石墨常用做电解池的电极 |
石墨的化学性质稳定且导电性好 |
I对、II对、有 |
下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是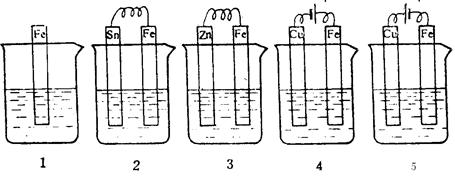
| A.4>2>1>3>5 | B.2>1>5>3>4 |
| C.5>4>2>3>1 | D.3>5>2>4>1 |