A、B、C、D、E、F六种短周期元素,且原子序数逐渐增大。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应。D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。回答下列问题:
(1)写出D的元素名称 ,D的气态氢化物的化学式 E的最高价氧化物的水化物的化学式 。
(2)画出B元素的离子结构示意图 。
(3)若构成F元素的一种核素的中子数为18,写出该核素的表示符号 。
(4)C与F元素最高价氧化物的水化物反应的离子方程式为 。
(5)将A、C、F的简单离子按照半径由大到小的顺序排列 (用离子符号表示)
A、B、C、D、E、F均为短周期元素;A、C具有相同的电子层数;E元素在B的下一周期;A与D同主族;原子半径大小为F>E>A>B>C。AC2常温下呈气态,通入紫色的石蕊溶液中会变红色,单质E可以在AC2中燃烧,发生置换反应。回答:
(1)AC2的分子构型为,E在AC2中燃烧的化学方程式为。
(2)A、D的最高价氧化物熔点更高是(填物质化学式),其理由是
。
(3)B、C、E、F均能形成简单 离子,其半径由大到小的顺序为。(用离子符号表示)
离子,其半径由大到小的顺序为。(用离子符号表示)
(4)F3B是一种离子化合物,能与水反应生成两种碱性物质。将F3B加入到足量的盐酸中,写出发生反应的离子方程式。
(5)A、E两元素形成阴、阳离子质量比为1∶1的离子化合物能与水反应生成一种气体,此气体的结构式为。
(4分)室温下,将铁片、铜片、铝片(表面用砂纸打磨过)分别投入浓盐酸、浓硫酸、浓硝酸、浓氢氧化钠溶液四种试剂中,做了12个实验,实验的编号如下表所示。
| 浓盐酸 |
浓硫酸 |
浓硝酸 |
浓氢氧化钠溶液 |
|
| 铝 |
实验1 |
实验2 |
实验3 |
实验4 |
| 铁 |
实验5 |
实验6 |
实验7 |
实验8 |
| 铜 |
实验9 |
实验1O |
实验11 |
实验12 |
回答有关上述实验的下列问题:
(1) 若给以上溶液加热,也不会发生化学反应的实验是和12(填实验编号)。
(2) 写出实验4发生的离子方程式 。
。
X、Y、Z、E、F为五种短周期元素,原子序数依次递增。X+只含有一个质子;Y的正、负化合价绝对值相等,在同族元素中其氢化物最稳定;Z的原子核内质子数是Y的最外层电子数的2倍;F与Z同主族;E与X同主族。试推断
(1)下列元素分别是: Y____, Z____,F。(用元素符号表示)
(2)X、Z、E形成化合物的电子式为 ,所含有的化学键有;它属于化合物(填“离子”或“共价”)。
,所含有的化学键有;它属于化合物(填“离子”或“共价”)。
下表标出的是元素周期表的一部分元素,回答下列问题: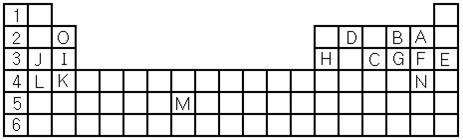
(1)表中用字母标出的15种元素中,金属性最强的是 (用元素符号表示,下同),非金属性最强的是,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物中以 最不稳定。(填化学式)
(3)除稀有气体外第三周期中原子半径最小的是 。(填元素符号)
(4)写出I、H元素的最高价氧化物对应水化物的酸(或碱)性强弱顺序 > (用化学式表示)
(5)B的氢化物电子式为用电子式表示G的氢化物形成过程,(物质用化学式表示)
胃舒平主要成分是氢氧化铝,同时含有三硅酸镁( )等化合物。
)等化合物。
(1)三硅酸镁的氧化物形式为_______
(2)铝原子的原子结构示意图为,写出氢氧化铝与胃酸反应的离子方程式。
(3)Al2O3、MgO和SiO2都可以制耐火材料,其主要原因是______。
| A. Al2O3、MgO和SiO2都不溶于水 | B.Al2O3、MgO和SiO2都有很高的熔点 |
| C.Al2O3、MgO和SiO2都是氧化物 | D.Al2O3、MgO和SiO2都是白色固体 |