PH=2的两种一元酸x和y,体积均为100ml,稀释过程中PH与溶液体积的关系如图所示,分别滴加 溶液(c=0.1
溶液(c=0.1 /L)至PH=7,消耗
/L)至PH=7,消耗 溶液的体积为Vx,Vy,则
溶液的体积为Vx,Vy,则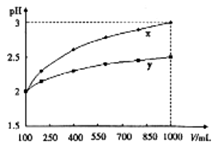
| A.x为弱酸Vx<Vy | B.x为强酸Vx>Vy | C.y为强酸Vx>Vy | D.y为弱酸Vx<Vy |
某探究小组在某温度下测定溶液的pH值时发现,0.01mol/L的 NaOH溶液中,由水电离出的c(H+)·c(OH-) = 10-22,则该探究小组在该温度下测得0.01mol/L的 NaOH溶液的pH值应为
| A.13 | B.12 | C.10 | D.11 |
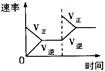
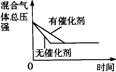
对于可逆反应N2(g)+3H2(g)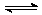 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
| A |
B |
C |
D |
|
| 研究目的 |
压强对反应的 影响(P2>P1) |
温度对反应的影响 |
平衡体系增加N2对反应的影响 |
催化剂对反应的 影响 |
| 图示 |
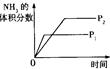 |
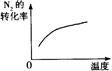 |
 |
 |
下列说法正确的是
| A.在气体反应中,升高温度和增大压强都能使单位体积内的反应物中活化分子数和活化分子百分数同时增大 |
| B.pH等于7的溶液一定呈中性 |
| C.c(H+)=c(OH-)的溶液一定呈中性 |
| D.在0.1mol/L的醋酸溶液中,加入少量水平衡向右移,电离平衡常数增大 |
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)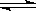 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是
(1)C的生成速率与C的分解速率相等;(2)单位时间内amol A生成,同时生成3amol B;(3)A、B、C的浓度不再变化;(4)混合气体的总压强不再变化;(5)混合气体的物质的量不再变化;(6)单位时间消耗amol A,同时生成3amol B;(7)A 、B、C的分子数目比为1:3:2。
A.(2)(5)B. (2)(7)C.(1)(3)D.(5)(6)