用惰性电极电解一定量的硫酸铜溶液,电解一段时间后,向电解液加入0.1 mol碱式碳铜晶体(不含结晶水),恰好使溶液恢复到电解前的浓度和pH。下列有关叙述不正确的是
| A.电解过程产生的气体体积(在标准状况下)为5.6 L |
B.电解过程只发生了2CuSO4+2H2O 2Cu+O2↑+2H2SO4 2Cu+O2↑+2H2SO4 |
| C.电解过程转移的电子数为3.612×1023个 |
| D.加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4====2CuSO4+CO2↑+3H2O |
常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,
甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进
行下列两实验:(已知:N2O4(g) 2NO2(g)△H> 0)
2NO2(g)△H> 0)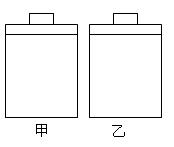
(a)将两容器置于沸水中加热
(b)在活塞上都加1 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
| A.(a)甲>乙,(b)甲>乙 | B.(a)甲>乙,(b)甲=乙 |
| C.(a)甲<乙,(b)甲>乙 | D.(a)甲>乙,(b)甲<乙 |
下列说法不正确的是
| A.电解质溶液导电的过程实际上就是电解的过程 |
| B.利用电解饱和食盐水所得的产物可以生产盐酸 |
| C.铜在酸性环境中易发生析氢腐蚀 |
| D.氢氧燃料电池的负极通入的是氢气 |
在理论上不能用于设计成原电池的化学反应是
①H2SO4(aq)+Ba(OH)2 (aq)=2H2O(l)+BaSO4(s);△H<0
②CH3CH2OH(l)+3O2(g)  2CO2(g)+3H2O(l) ;△H<0
2CO2(g)+3H2O(l) ;△H<0
③2FeCl3(aq)+Cu(s)=2FeCl2(aq)+CuCl2(aq);△H<0
④C(s)+CO2(g)=2CO(g) ;△H>0
| A.④ | B.①④ | C.①② | D.②③ |
下列关于平衡常数的说法正确的是
| A.一定温度下的可逆反应,只有达到平衡时才具有平衡常数 |
| B.化学平衡移动时,平衡常数一定改变 |
| C.对于一个确定的反应来说,平衡常数的数值越大,反应限度越大 |
| D.化学平衡常数大的可逆反应,所有反应物的转化率一定大 |
下列反应中,一定不能自发进行的是
| A.2KClO3(s)=" 2KCl(s)+" 3O2(g)ΔH = -78.03 kJ·mol-1,ΔS =" 494.4" J·mol-1·K-1 |
B.CO(g)= C(s,石墨)+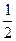 O2(g)ΔH =" 110.5" kJ·mol-1,ΔS = -89.4 J·mol-1·K-1 O2(g)ΔH =" 110.5" kJ·mol-1,ΔS = -89.4 J·mol-1·K-1 |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g)= 4Fe(OH)3(s) ΔH = -444.3 kJ·mol-1,ΔS = -280.1 J·mol-1·K-1 |
| D.NH4HCO3(s) + CH3COOH(aq) = CH3COONH4 (aq) + CO2(g) +H2O(l) |
ΔH =" 37.30" kJ·mol-1,ΔS =" 184.0" J·mol-1·K-1