几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
M |
R |
| 原子半径/nm |
0.186 |
0.102 |
0.075 |
0.074 |
0.143 |
| 主要化合价 |
+1 |
+6 -2 |
+5 -3 |
-2 |
+3 |
已知X是短周期中最活泼的金属,且与R同周期。下列叙述不正确的是
A.离子半径大小:Y2->M2->R3+
B.Y与M组成的化合物是形成酸雨的原因之一
C.将YM2通入BaCl2溶液中有大量白色沉淀产生
D.X的最高价氧化物的水化物碱性大于R最高价氧化物的水化物碱性
在恒温下的密闭容器中,有可逆反应:2NO+O2 2NO2(正反应为放热反应),不能说明已经达到平衡状态的是
2NO2(正反应为放热反应),不能说明已经达到平衡状态的是
| A.正反应生成NO2的速率和逆反应生成O2的速率相等 |
| B.反应容器中压强不随时间的变化而变化 |
| C.混合气体颜色保持不变 |
| D.混合气体的平均相对分子质量不随时间变化而变化 |
有一处于平衡状态的反应:X(s)+3Y(g) 2Z(g)(正反应是放热反应)。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g)(正反应是放热反应)。为了使平衡向生成Z的方向移动,应选择的条件是
①增加X ②降低温度 ③增大压强 ④降低压强⑤加入正催化剂 ⑥分离出Z
| A.①③⑤ | B.②③⑥ | C.②③⑤ | D.②④⑥ |
在一密闭容器中进行以下可逆反应:M(g)+P(g) N(g)+2 L。在不同的条件下P的百分含量P%的变化情况如图,则该反应
N(g)+2 L。在不同的条件下P的百分含量P%的变化情况如图,则该反应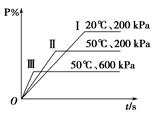
| A.正反应放热,L是固体 | B.正反应吸热,L是气体 |
| C.正反应吸热,L是固态 | D.正反应放热,L是固体或气体 |
在密闭容器中进行反应X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.1 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.1 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
| A.Y2为0.1 mol·L-1 | B.X2为0.1 mol·L-1 |
| C.Y2为0.35 mol·L-1 | D.Z为0.3 mol·L-1 |
将1 mol冰醋酸加入到一定量的蒸馏水中最终得到1 L溶液。下列各项中,表明已达到电离平衡状态的是
| A.醋酸的浓度达到1 mol·L-1 |
| B.H+的浓度达到0.5 mol·L-1 |
| C.醋酸分子的浓度、醋酸根离子的浓度、H+的浓度均为0.5 mol·L-1 |
| D.醋酸分子电离成离子的速率和离子重新结合成醋酸分子的速率相等 |