把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的浊液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答: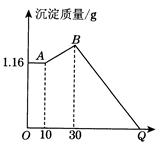
(1)A点的沉淀物的化学式为 ;B点的沉淀物的化学式为 。
(2)原混合物中MgCl2的质量是________g,AlCl3的质量是________g,NaOH的质量是_______g。
(3)Q点HCl溶液加入量是________mL。
已知实验室制氯气的化学方程式为:MnO2+ 4HCl (浓) = MnCl2+ Cl2↑+2H2O,现用足量浓盐酸在加热条件下跟二氧化锰反应制取氯气。若标准状况下制得Cl22.24L求:
(1)二氧化锰的质量;
(2)把(1)中反应后的溶液稀释到50 mL,从中取出10.0 mL,加入10.0 mL 0.600 mol / L的硝酸银溶液,恰好将氯离子完全沉淀。求(1)中反应后溶液稀释到50 mL时氯离子的物质的量浓度是多少?
在200mL稀硫酸和稀盐酸的混合溶液中,加入4.275g Ba(OH)2粉末,充分反应后过滤,得沉淀2.33g;又测知反应后的溶液中OH—的物质的量浓度为0.1mol·L—1。试求混合酸溶液中Cl—和SO42—的物质的量浓度。(假设反应前后溶液的总体积不变)
某温度下,50 mL NaOH饱和溶液的质量为60g,把它蒸干后得到固体NaOH 20g。求该温度下溶液中NaOH的质量分数和物质的量浓度。
为除去粗盐中的Ca2+、Mg2+、SO42—以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)第①步中,操作A是,第⑤步中,操作B;
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
,;
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
。
将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液。试计算所得溶液中硫酸锌的物质的量浓度是多少?