下列表述正确的是
| A.0.1mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B.0.1mol·L-1CH3COONa溶液中:c(Na+)=c(CH3COO-)+c(OH-) |
| C.CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:c (NaOH)<c(Na2CO3)<c(CH3COONa) |
| D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,离子浓度的关系:c(CH3COO-)>c(Na+)>c(OH-)=c(H+) |
下图表示可逆反应mA(g) +nB(s)  xC(g)在不同温度和压强下,反应物A的转化率变化情况。下列判断正确的是
xC(g)在不同温度和压强下,反应物A的转化率变化情况。下列判断正确的是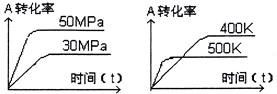
| A.m>x,正反应为放热反应 |
| B.m+n<x,正反应为吸热反应 |
| C.m<x,正反应为放热反应 |
| D.m>x,正反应为吸热反应 |
已知pOH=-lg[OH-],下列溶液一定呈中性的是
| A.由等体积、等物质的量浓度的一元酸跟NaOH溶液混合后所形成的溶液 |
| B.[H+]=1.0×10-7mol·L-1的溶液 |
| C.pH=14-pOH的溶液 |
| D.pH=pOH的溶液 |
一定量的气体在密闭容器中发生反应:xA(g) + yB(g)  zC(g),平衡时测得A的浓度为1.0mol/L,保持温度不变,将容器的容积扩大到原来的2倍,达新平衡后, 测得A的浓度降低为0.60 mol/L。下列有关判断正确的是
zC(g),平衡时测得A的浓度为1.0mol/L,保持温度不变,将容器的容积扩大到原来的2倍,达新平衡后, 测得A的浓度降低为0.60 mol/L。下列有关判断正确的是
| A.平衡向正反应方向移动 |
| B.物质B的转化率降低 |
| C.x + y < z |
| D.物质C的体积分数增大 |
下列说法正确的是
| A.常温下,在0.1mol/LNaOH溶液和0.1mol/L盐酸中水的离子积相等 |
| B.常温下,在水中加入NaOH,水的电离受到抑制,水的离子积减小 |
| C.HCl溶液中无OH-,NaOH溶液中无H+,NaCl溶液中既无OH-也无H+ |
| D.在水溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
某可逆反应过程的能量变化如图所示,下列说法正确的是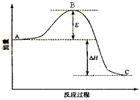
| A.该反应过程为吸热反应 |
| B.若加入催化剂,ΔH数值会减小 |
| C.若加入催化剂,B点会降低 |
| D.若升高温度,则平衡向正反应方向移动 |