下列离子方程式中,正确的是
| A.Na2O2与H2O反应:Na2O2 + H2O= 2Na+ + 2OH-+ O2↑ |
| B.AlCl3溶液中滴加过量的氨水:Al3+ +4 NH3·H2O=AlO2— + 2H2O + 4NH4+ |
| C.铜与浓硝酸反应:Cu +4H+ + 2NO3- = Cu2+ + 2NO2↑ + 2H2O |
| D.向小苏打溶液中滴入醋酸:CO32-+ 2CH3COOH=CO2↑+ H2O+ 2CH3COO- |
下列图像表达正确的是
| A.图①表示25℃时,用0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液 |
| B.图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应 |
| C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.图④表示向盐酸和醋酸混合溶液中滴入氨水 |
某同学设计如下实验测量m g铜银合金样品中铜的质量分数:
下列说法中不正确的是
| A.收集到的V L气体为 NO |
| B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒 |
| C.操作Ⅱ应是洗涤 |
D.铜的质量分数为: ×100% ×100% |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下的33.6 L氯气与27 g铝充分反应,转移的电子数为3NA |
| B.标准状况下,0.5 NA个NO和0.5 NA个O2混合气体的体积约为22.4 L |
| C.一定条件下,将1 mol N2与3 mol H2混合反应后,生成NH3分子的数目为2NA |
| D.在电解CuSO4溶液的实验中,测得电解后溶液pH=0,又知电解后溶液体积为1 L,在阳极析出的气体分子数约为0.25NA |
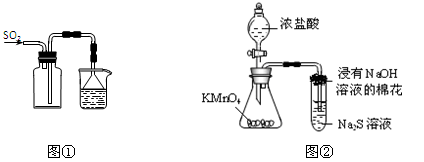
下列实验操作能够达到实验目的的是
| A.实验室采用图①所示装置收集SO2 |
| B.可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱[ |
| C.除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤 |
| D.称取0.40g NaOH,放入100 mL容量瓶中,配制0.10 mol/L NaOH溶液 |
下列离子方程式书写正确的是
| A.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: 3ClO—+Fe(OH)3= FeO42—+3Cl—+H2O+4H+ |
| B.用Na2O2与H2O反应制备O2:Na2O2+ H2O=2Na++2OH-+ O2↑ |
| C.向Fe(NO3)2溶液中加入过量的HI溶液 3Fe2++NO-3+4H+-=3Fe3++NO↑+2H2O |
D.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液: |