第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如下图所示,则下列说法中正确的是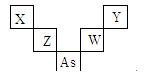
| A.Z的氧化物可与Y的氢化物水溶液发生化学反应 |
| B.X的原子半径比As原子半径小,两者原子序数之差为29 |
| C.W的氧化物对应的水化物是共价化合物,并且必是强酸 |
| D.图中五种元素均是非金属元素,并且Y的非金属性最强 |
下列事实中,能说明氯的非金属性比硫强的是( )
①HClO的氧化性比H2SO4的氧化性强
②常温下氯气是气态而硫是固态
③盐酸酸性比氢硫酸强
④HCl比H2S稳定
⑤H2S能被Cl2氧化成硫
⑥SCl2分子中氯显-1价
⑦氯气与氢气化合比硫与氢气化合要容易进行
⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
| A.①②③④⑤⑥⑦⑧ | B.①④⑤⑥⑦ |
| C.④⑤⑥⑦⑧ | D.③④⑤⑦⑧ |
X、Y是元素周期表ⅦA族中的两种元素.下列叙述中能说明X的非金属性比Y的非金属性强的是( )
| A.X原子的电子层数比Y原子的电子层数多 |
| B.X的氢化物的沸点比Y的氢化物的沸点低 |
| C.X的气态氢化物比Y的气态氢化物稳定 |
| D.Y的单质能将X从NaX的溶液中置换出来 |
元素周期律和元素周期表是学习化学的重要工具,下列说法正确的是( )
| A.门捷列夫根据原子量排列的周期表成功预言了类铝(镓)、类硅(锗)等元素的存在 |
| B.铀(U)属于过渡元素,能跟氟形成UF6,据此可推测U原子最外层有6个电子 |
| C.HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱,沸点依次升高 |
| D.Na、Mg、Al原子的最外层电子数依次增加,故失去电子的能力越来越强 |
下列气态氢化物最稳定的是( )
| A.HF | B.HCl | C.HBr | D.H2S |
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-具有相同的电子层结构,下列关系正确的是( )
| A.质子数:c>d |
| B.离子的还原性:Y2->Z- |
| C.氢化物的稳定性:H2Y>HZ |
| D.原子半径:X<W |