常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.c(ClO-)=1.0mol·L-1的溶液中:Na+、SO32-、S2-、SO42- |
| B.常温下,C(H+)/C(OH— )=10-10的溶液中:Ca2+、Mg2+、HCO3-、I- |
| C.由水电离的c(H+)=1×10-12 mol·L-1的溶液中:Ba2+、K+、Cl-、NO3- |
| D.滴入少量KSCN溶液显红色的溶液中:Na+、K+、I-、SO42- |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是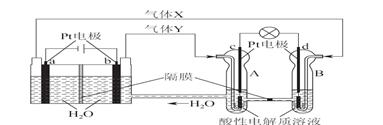
A.转移0.1mol电子时,a电极产生1.12LH2
B.b电极上发生还原反应
C.酸性电解质溶液中H+移向c电极
D.d电极上发生的电极反应是:O2+4H++4e-===2H2O
往含等物质的量的偏铝酸钠与氢氧化钠的混合溶液中通入二氧化碳,产生沉淀的量与通入二氧化碳的量关系正确的是

下列说法正确的是
A.已知 则可以计算CH3—CH3 → CH2=CH2+H2;ΔH =+125.6 kJ/mol 则可以计算CH3—CH3 → CH2=CH2+H2;ΔH =+125.6 kJ/mol |
| B.能说明NH3结合H+能力比H2O强:NH3+H3O+=NH+4+H2O |
| C.已知下列热化学方程式:2H2(g)+O2(g) ="==" 2H2O(g) △H=-484kJ/mol,则氢气的燃烧热为-242kJ/mol |
| D.已知中和热为-57.4kJ/mol ,则NaOH(aq) +CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H =-57.4kJ/mol |
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如右图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色。则下列说法中不正确的是
| A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
| B.该条件下H2燃烧的产物中可能含有一定量的H2O2 |
| C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质 |
| D.水凝固形成20℃时的“暖冰”所发生的变化是化学变化 |
SO2通入足量Fe(NO3)3稀溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化过程中,下列说法中不正确的是
| A.上述过程中,最终被还原的是NO3— |
| B.从上述过程中可以得出结论,氧化性:HNO3>Fe3+>稀H2SO4 |
| C.假设通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积为1∶1 |
| D.上述过程中,会产生一种无色无味的难溶于水的气体 |