实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应如下:
已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)。
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸。
③石蜡油沸点高于250℃
④苯甲醇沸点为205.3℃
实验步骤如下:
①向图l所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20 mL,摇动均匀,冷却至室温。然后用乙醚萃取三次,每次10 mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10 mL 10%碳酸钠溶液洗涤,10 mL水洗涤,然后分液,将水层弃去,所得醚层进行实验步骤③。
③将分出的醚层,倒入干燥的锥形瓶中,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2所示的蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必须改变加热方式、冷凝方式,继续升高温度并收集205℃~206℃的馏分得产品A。
④将实验步骤②中保留待用的水层慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需 (仪器名称)。
(2)步骤②中饱和亚硫酸氢钠溶液洗涤是为了除去 ,而用碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。醚层中少量的苯甲酸是从水层转移过来的,请用离子方程式说明其产生的原因 。
(3)步骤③中无水硫酸镁的作用是 ,锥形瓶上要加塞的原因是 ,产品A为 。
(4)步骤③中蒸馏除去乙醚的过程中采用的加热方式为 ;蒸馏得产品A的加热方式是 。
(5)步骤④中提纯产品B时所用到的实验方法为 。
用下图所示实验装置制取乙酸乙酯。回答以下问题: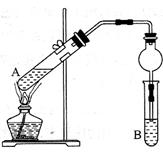
(1)在A试管中配置好体积比为3:2的乙醇和乙酸,加热至沸腾,很久都末有果香味液体生成,原因是
____________________________________________。
(2)B试管中所装溶液应为_________,乙酸乙酯生成后,将在该溶液的___________(填“上”或“下”)层,分离出产品所需的主要仪器是______________________。
(3)与教材采用的实验装置不同,这位老师采用球形干燥管代替长导管,并将干燥管的末端插入B中液面以下,在此处,球形干燥管的作用有
①________________________________,②______________________________。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题: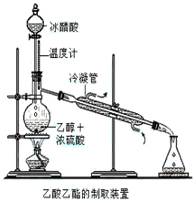
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,
还应放入几块碎瓷片,其目的_____________。
(2)配制乙醇和浓硫酸的混合液的方法是:先在烧瓶中加入一定量的,然后慢慢将加入烧瓶,边加边振荡。
(3)在该实验中,若用1 mol乙醇和1 mol 乙酸在浓硫
作用下加热,充分反应,不能生成1 mol乙酸乙酯的原因是
。
(4)锥形瓶中得到乙酸、乙醇和水的乙酸乙酯的混合物,欲得到乙酸乙酯并闻到它的气味,需将混合液先用溶液处理,再用
(填一种仪器名称)分离。
(5)葡萄糖是生命现象中的一种能量物质。现取少量葡萄糖溶液于试管中,加入新制的Cu(OH)2悬浊液,加热煮沸后现象是,说明分子中含有的官能团是,反应的化学方程式是:
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。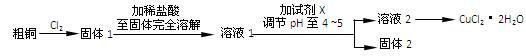
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固 体1(部分仪器和夹持装置已略去)。
体1(部分仪器和夹持装置已略去)。
①仪器A的名称是。
②装置B中发生反应的离子方程式是。
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)。
④ NaOH溶液的作用
(2)试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)。
a.NaOH b.NH3·H2O c.CuO d.Cu2(OH) 2CO3 e.CuSO4
下图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。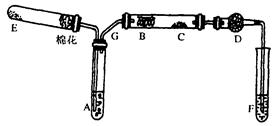
图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。
(1) E处是一种纯净物,其发生反应的化学方程式为___ _____。
(2)为使A中乙醇平稳汽化成乙醇蒸气,常采用的方法是_______ ______。
D处使用碱石灰的作用是__ _____。
(3)能证明乙醇反应后产物的实验现象是
。
(4)本实验中若不加热E处,其他操作不变,则发现C处无明显变化,而F处现象与(3)相同。推断B处发生反应的化学方程式____。
用图示装置制取少量乙酸乙酯(酒精灯、铁架台等在图中均已略去),请填空: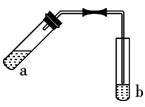
(1)写出试管a中发生反应的化学方程式
(2)某同学在实验过程中,试管a中忘记加入碎瓷片就加热进行实验,为防止暴沸,下一步的操作是:。
(3)实验中加热试管a的目的是:
①:
②:
(4)反应结束后,振荡试管b静置,观察到的现象是
。