(10分)甲醇合成反应为:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)合成甲醇的反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式 。
(2)实验室在lL密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol•L—l)
| 温度\时间 |
10min |
20min |
30min |
40min |
50min |
60min |
| 300 ℃ |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
| 500 ℃ |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
①300 ℃时反应开始10分钟内,H2的平均反应速率为 ;
②500 ℃时平衡常数K的数值为 ;
③300 ℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (选填编号)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时 减小
减小
(3)下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
①甲中负极的电极反应式为 ;
②乙中A极析出的气体在标准状况下的体积为 ;
③反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要 mL5.0 mol•L—lNaOH 溶液。
(1)写出下列物质在水溶液中的电离方程式
①碳酸氢钠 ②氯酸钾
(2)写出下列反应的离子方程式
①氢氧化铜和稀盐酸反应_____________________
②用稀硫酸清洗铁锈(Fe2O3)___________ ______
按要求完成下列各题
(1)、精炼铜时,阴极材料是 ,阴极的电极反应式是 ,
(2)、氯碱工业电解饱和食盐水的总反应方程式为 。
(3)、MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是
(4)、为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-离子。电池工作时正极反应式为________________。
若以该电池为电源,用石墨做电极电解100 mL含有如下离子的溶液。
| 离子 |
Cu2+ |
H+ |
Cl- |
SO |
| c/(mol·L-1) |
1 |
4 |
4 |
1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为________mol。
高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g) 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
(1)该反应的平衡常数表达式K=________ ,ΔH________0(填“>”、“<”或“=”);
(2)在一个容积为5L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时比较v(正) v(逆) (填“>” “="”" “<”),反应经过2min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________ ,CO的平衡转化率=________ ;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A、减少Fe的量 B、增加Fe2O3的量 C、移出部分CO2
D、提高反应温度 E、减小容器的容积 F、加入合适的催化剂
在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则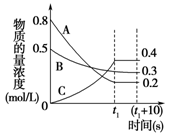
(1)、该反应的化学方程式为: ;
(2)、t1 s时反应物A的转化率为: ;
(3)、0~t1 s内A的反应速率为v(A)= ;
按要求回答下列问题
(1)、4g CO在氧气中燃烧生成CO2,放出 9. 6kJ热量,写出CO燃烧的热化学方程式。_____________________________
(2)、已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________________
(3)、已知碳的燃烧热ΔH1=" a" kJ·mol-1S(s)+2K(s)==K2S(s)ΔH2=" b" kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s)ΔH3=" c" kJ·mol-1
则S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH=
(4)、已知:C(s)+O2(g)=CO2(g)ΔH="-437.3" kJ·mol一1
H2(g)+1/2O2(g)=H2O(g)ΔH="-285.8" kJ·mol一1
CO(g)+1/2O2(g)=CO2(g)ΔH="-283.0" kJ·mol一1
写出煤气化(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式
计算10m3(标况)水煤气完全燃烧放出的热量为 kJ(结果保留到小数点后一位)。