NH3能被O2氧化生成NO,进而氧化成NO2,用来制造硝酸;将NO2(g)转化为N2O4(l),再制备浓硝酸。
(1)2NO(g)+ O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。
①P1______(填“>”或“<”)P2
②随温度升高,该反应平衡常数变化的趋势是____________。
(2)已2NO2(g) N2O4(g) △H1<0
N2O4(g) △H1<0
2NO2(g) N2O4(l) △H2<0
N2O4(l) △H2<0
下列能量变化示意图中,正确的是_______(填序号)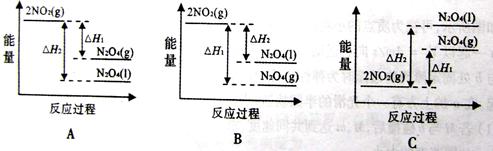
(3)50℃时在容积为1.0L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
①50℃时,体系中各物质浓度随时间变化如图所示。在0~60s 时段,反应速率v(NO2)为_________mol/(L·s)。
②T______(填“>”或“<”) 50℃。
③计算温度T时该反应的平衡常数K(写出计算过程)。
(4)科学家正在开发以氨代替氢气的新型燃料电池有许多优点;制氨工业基础好、技术成熟、成本低、储运方便等。直接供氨式碱性(KOH)燃料电池的总反应为:4NH3+3O2==2N2+6H2O,氨气应通入_______(填“正极”或“负极”)室,正极反应式为_____________________________
元素A的阳离子与元素B的阴离子具有相同的电子层结构。以下关于A、B元素性质的比较中,正确的是
①原子半径:A<B ②原子序数:A>B③原子最外层电子数:B>A
④元素所在的周期数:A>B⑤A的最高正价与B的最低负价的绝对值相等
A、①② B、②③④ C、④⑤ D、②⑤
日本的白川英树、美国的马克迪尔米德和艾伦·黑格尔,由于发现了掺杂聚乙炔具有良好导电性而共同获得2000年诺贝尔化学奖。以下关于聚乙炔的叙述错误的是
| A.单体为不饱和烃 | B.聚乙炔的分子中含有碳碳双键 |
| C.聚乙炔的相对分子量为26 | D.聚乙炔可用于生产导电橡胶 |
某不饱和有机物结构为CH3─CH═CH─COOH,该化合物不可能发生的反应是
| A.加成反应 | B.酯化反应 | C.水解反应 | D.与碳酸氢钠溶液反应 |
下列物质不能和氢氧化钠溶液反应的是
| A.氨基乙酸 | B.乙醇 | C.油酸甘油酯 | D.醋酸铵 |
某试管中盛有碘的苯溶液,加入少量的乙酸乙酯,充分振荡,静置片刻后
| A.整个溶液变蓝色 | B.整个溶液显紫红色 |
| C.上层无色,下层紫红色 | D.上层紫红色,下层无色 |