已知酸H2B在水溶液中存在下列关系:①H2B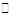 H++HB-②HB-
H++HB-②HB-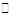 H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是
H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是
| A.NaHB属于弱电解质 |
| B.溶液中的离子浓度[Na+]>[HB-]>[H+]>[OH-] |
| C.[Na+]=[HB-]+[B2-]+[H2B] |
| D.NaHB和NaOH溶液反应的离子方程式为H++OH-===H2O |
下列关于卤素的叙述中正确的是()
①卤素的钾盐中,最易被氧化是氟化钾:②溴中溶有少量氯气,可以用加入溴化钠再用汽油萃取的方法提纯;③溴化银具有感光性,碘化银不具感光性;④某溶液与淀粉碘化钾溶液反应出现蓝色,则证明该溶液是氯水或溴水;⑤氟气跟氯化钠水溶液反应,一定有HF和O2生成;⑥氯气跟水反应时,水既不是氧化剂也不是还原剂
| A.①③⑤ | B.②④⑥ | C.②⑤⑥ | D.①③④ |
向下图装置中缓慢地通入气体X,若关闭活塞,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞,则品红溶液退色,加热后又恢复红色。据此判断气体X和洗气瓶内溶液Y分别可能是()
下列物质能通过化合反应直接制得的是()
①FeCl2②H2SO4③NH4NO3④HCl
| A.只有①②③ |
| B.只有②③ |
| C.只有①③④ |
| D.全部 |
某种解热阵痛药的结构简式如图关于该物质的说法正确的是()
| A.分子中含有一个肽键,是一种二肽 |
| B.当它完全水解时,可得到的产物有4种 |
| C.该物质苯环上的一硝基取代物有6种 |
D.水解产物之一为 ,该物质显酸性的异构体有3种(包括其本身) ,该物质显酸性的异构体有3种(包括其本身) |
缬氨霉素是一种脂溶性的抗生素,由12个分子组成的环状化合物,它结构如下图所示,有关说法正确的是()
