红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
请回答下列问题。
(1)气态 PCl5生成气态PCl3和Cl2的热化学方程式为 。
(2)PC15生成 PCl3和Cl2是一个可逆反应,向5.0L密闭容器中充入0.1 md PCl5(g),反应在不同条件下进行,反应体系总压强随时间的变化关系如图所示。
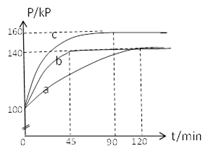
①实验b中PCl5的平衡分解率为 ,其他条件不变,在该实验中再加入 0.1 mol PCl5 (g) ,平衡分解率 (填“增大”、“减小”或“不变”)。
②与实验a相比,c改变的条件是 ,判断依据是 。
(3)PCl5露置于潮湿空气中,能水解生成两种中学化学常见酸,其化学方程式为 。
(4)人的牙齿表面有一层釉质,其组成为羟基磷灰石 Ca5( PO4)3OH(Ksp=6.8×10-37)。为了防止蛀牙,人们常使用含氟离子的牙膏,其中的氟化物可使轻基磷灰石转化为氟磷灰石Ca5( PO4)3F(Ksp=1.0×10-60)。写出该反应的离子方程式 ,该反应的平衡常数为 。
(12分)A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的―1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1) )画出D元素的原子结构示意图____ ________。
________。
(2)与E的氢化物分子所含电子总数相等的分子是____________(举一例、填化学式,下同)、阳离子是____________、阴离子是。
(3) B的最高价氧化物对应的水化物中含有化学键的类型是____________。
(4) D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为__________________________________________。
现有如下两个反应:(A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Cu=2FeCl2 +CuCl2
(1)根据两反应本质,判断能否设计成原电池___________________________________
(2)如果不能,说明其原因__________________________________________ _________
_________
(3)如果可以,请写出正负极材料名称和电极反应式。
________是正极,正极反应式:______________________
________是负极,负极反应式:______________________
合成氨和制备硝酸是两种重要的化工生产,四川某化工厂将合成氨与制备硝酸进行连续生产。其工艺流程见右图:
(1)在某温度下体积为200 L的氨合成塔中,以分为单位的时间点上测得各物质 的浓度(mol·L-1)
的浓度(mol·L-1)
如下表:
根据表中数据得知0 min~2 min内N2的平均反应速率是,若用CH4与过量水蒸气反应来制氢气,再与氮气合成氨,则理论上CH4与NH3的物质的量之比是。
(2)今对合成氨反应进行如下研究:
在容积均为10 L的a、b、c三个相同密闭容器
L的a、b、c三个相同密闭容器 中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如右图所示。则下列说法正确的是。
中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如右图所示。则下列说法正确的是。
| A.a、b、c三容器5 min时的正反应速率大小为:b>a>c |
| B.达到平衡时,a、b、c三容器中N2转化率为a>b>c |
| C.5 min时,a、b、c三容器中的反应均可能达到平衡状态。 |
| D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压 |
(3)工业上常用尿素作为氮氧化物的吸收剂对尾气进行处理。此法运行费用低,吸收效果好,吸收率高,不产生二次污染。其主要的反应为氮氧化物混合气与水反应生成亚硝酸(HN02),亚硝酸再与尿素[CO(NH2)2]反应生成CO2和N2。 ①HNO2的电子式_________________________
①HNO2的电子式_________________________
②亚硝酸与尿素[CO (NH2)2]反应的化学方程式为_____________________
(4)已知:N2(g)+O2(g)==2NO(g);△H= +180.5kJ/mol
4NH(g)+5O2(g)=4NO(g)+6H2O(g);△H="-905" kJ/mol
2H2(g)+O2(g) =2H2O(g);△H=—483.6 kJ/mol
则在该条件下,氨合成塔中所发生反应的热化学方程式为:
(5)取200 mL的硝酸恰好与32 g Cu2S完全反应,已知硝酸被还原成等物质的量的NO和NO2另外还有CuSO4和Cu(NO3)2生成,则所得工业硝酸的浓度是_mol·L-1。
存在于茶叶中的芳香族化合物A,其氧元素的质量分数为29.27%,苯环上的一氯代物有两种。1mol A分别与足量昀NaHCO3溶液和NaOH溶液反应,消耗的两种物质的量之比 为1:2。
为1:2。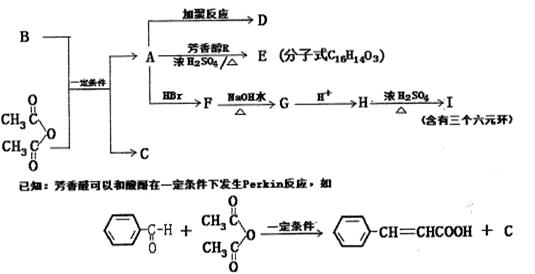
(1)写出下列物质的结构筒式:CD
(2)A中含氧官能团的名称是,H—I的反应类型
B物质不能发生的反应类型有(填选项)
①取代反应②加成反应③消去反应④氧化反应⑤还原反应⑥水解反应
(3)写出下列反应的化学方程式:
A→E:
F→G:
(4)写出满足下列条件的A的所有同分异构体
①苯环上的一取代酯,②除苯环外不再含有其他的环状结构,
③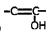 结构不稳定,容易转化为
结构不稳定,容易转化为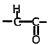
④能与金属Na反应写出满足上述条件的任意一种同分异构体与NaOH溶液反应的化学方程式
下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。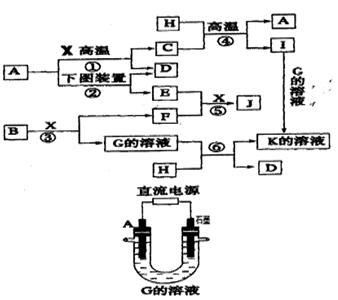
请按要求填空:
(1)反应⑤的现象是。反应③中若转移3NA电子,则被氧化的B是mol
(2)反应①的化学方程式是,在实验室中引发反应④的操作是。
(3)实验室用上图中的电解池制备E,与A相连的直流电源的电极名称为
A电极的电极反应式,下列溶液能代替G溶液的是。
A.稀硫酸 B.NaCl溶液 C.K2CO3溶液 D.CuCl2溶液
(4)现有J与稀硝酸恰好完全后的溶液
①在上述溶液中加入少量HI溶液的离子方程式为
②若要从上述溶液中得到晶体,正确的操作为:先,再降温结晶,过滤即可得所需晶体。