某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料。下列说法正确的是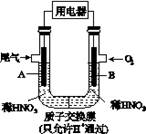
A.电极A表面反应之一为NO2-e-+H2O==NO3-+2H+
B.电极B附近的c(NO3-)增大
C.电解质溶液中电流的方向由B到A,电子的流向与之相反
D.该电池工作时,每转移4 mol电子,生成22.4 L O2
相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是
| A.C3H4和C2H6 | B.C3H6和C3H8O |
| C.C3H6O2和C3H8O | D.C3H8O和C4H6O2 |
下列关于有机物的说法错误的是()
| A. |
可由 制得,可萃取碘水中的碘 |
| B. |
石油和天然气的主要成分都是碳氢化合物 |
| C. |
乙醇、乙酸和乙酸乙酯能用饱和 溶液鉴别 |
| D. |
苯不能使 溶液褪色,因此苯不能发生氧化反应 |
盛有氯化钡稀溶液甲乙两试管分别通入SO2至饱和,若向甲试管中加入足量硝酸,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是
A.甲、乙两试管都有白色沉淀生成 |
B.甲、乙两试管都没有白 色沉淀生成 色沉淀生成 |
C.甲试管没有白色沉淀生成而乙试管有 |
D.甲试管有白色沉淀生成而乙试管没有 |
已知相同浓度的碳酸中c(CO32-)比偏铝酸中的c(AlO2—)大得多,则下列推论中正确的()
| A.通入适量CO2于AlO2-溶液中,有CO32-生成 |
| B.含CO32-的溶液容易使Al(OH)3溶解变成AlO2- |
| C.HCO3-只能Al3+反应而不能和A1O2—反应 |
| D.在水溶液中HCO3-不能与A1O2—大量共存 |
石油炼制过程中,既能提高汽油产量又能提高汽油质量的方法是()
A 常压分馏 B减压分馏 C 裂解 D 催化裂化