在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)  xC(g) △H>0,其它条件不变,只有温度改变时,某量随温度变化关系如图。则下列说法中错误的是
xC(g) △H>0,其它条件不变,只有温度改变时,某量随温度变化关系如图。则下列说法中错误的是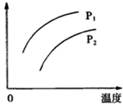
| A.纵坐标可能表示C的产率 |
| B.纵坐标一定可以表示混合气体平均摩尔质量 |
| C.若p1>p2,则x=1或2 |
| D.x的取值与p1、p2的相对大小有关 |
下列有关化学键的说法中错误的是
| A.氯化钠熔化或氯化氢溶于水时都要破坏化学键 |
| B.离子化合物中可能含有共价键,共价化合物中一定不含有离子键 |
| C.氯化铵受热变成气体,冷却后又成晶体,此过程中化学键没有发生变化 |
| D.碘晶体升华和冰融化时都未涉及化学键的变化 |
如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是
| A.1 mol H2中的化学键断裂时需要吸收436 kJ能量 |
| B.2 mol HCl分子中的化学键形成时要释放862 kJ能量 |
| C.此反应的热化学方程式为:H2(g)+Cl2(g)===2HCl(g) ΔH=+183 kJ/mol |
D.此反应的热化学方程式为: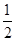 H2(g)+ H2(g)+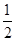 Cl2(g)===HCl(g) ΔH=-91.5 kJ/mol Cl2(g)===HCl(g) ΔH=-91.5 kJ/mol |
某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄绿色气体产生,则下列说法正确的是
| A.X2+具有强氧化性 | B.X的最高正价为+2价 |
| C.XO2具有强氧化性 | D.该元素是ⅡA族 |
如图是元素周期表的一部分,关于图中阴影部分元素的说法中, 正确的是
| A.N元素为第一周期元素 |
| B.PH3的稳定性比H2S强 |
| C.该纵行元素的最高价氧化物对应的水化物化学式均为H3RO4 |
| D.H3AsO4的酸性比H3PO4弱 |
已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
| A.质子数c>b | B.离子的还原性Z-> Y2- |
| C.氢化物的稳定性H2Y>HZ | D.原子半径X>W |