某实验小组的同学对电化学原理进行了一系列探究活动
(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示) 设计的原电池装置,反应前,两电极质量相等,一段时间后,两电极质量相差18g,则导线中通过 mol电子。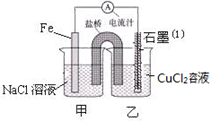
(2)用胶头滴管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 ,然后滴加几滴硫氰化钾溶液,溶液变红;继续滴加过量新制饱和氯水,红色褪去,假设之一是“溶液中的+3价铁被氧化为更高的价态”。如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
(3)如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,石墨(1)为 极(填“正”、“负”、“阴”或 “阳”)。在甲装置中滴加几滴酚酞试液,振荡均匀,一段时间后,在甲装置中观察到 电极(填“铁”或“铜”)附近溶液先变红,该电极的反应式为 。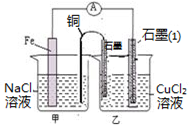
根据下图所示的关系填空,已知A为FeS2固体,C的焰色反应火焰呈 黄色,其中①、③是硫酸工业生产中的重要反应,D、E常温下为气体,X常温下为无色液体,F是红棕色固体。
黄色,其中①、③是硫酸工业生产中的重要反应,D、E常温下为气体,X常温下为无色液体,F是红棕色固体。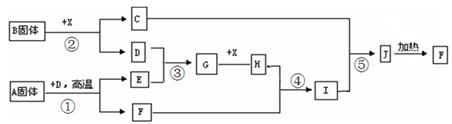
(1)物质X的化学式是 ____。
(2)化合物B中所包含的化学键有和 __。
(3)反应④的离子方程式为。
反应②的化学方程式为___ ___,其中还原剂是。
(4)已知每生成16克E,放出106.5KJ的热量,则反应①的热化学反应方程式为 ___。
下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B与气体C相遇产生大量的白烟,D是海水中浓度最高的盐(部分反应物和生成物及溶剂水已略去)。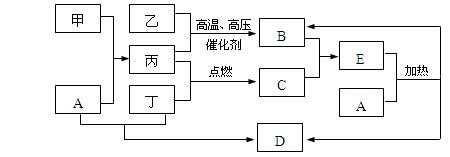
请回答下列问题:
⑴甲的化学式是,C的电子式为;
⑵写出A溶液和丁反应生成D的离子方程式:;
⑶写出A和E反应的化学方程式:。
Ⅰ. 有下列10种有机物,请回答有关问题。
(1)属于芳香烃的是;(填序号,下同)
(2)属于醇类的是 __;
(3)核磁共振氢谱图上只有一个峰的是 __;
(4)有机物②中官能团的名称是 __ ;
(5)有机物④的最简单同系物的结构简式是。
Ⅱ.(1)烃( )的系统命名法的名称是;
)的系统命名法的名称是;
(2)下列有机物中,含有两种官能团的是;
A.CH3-CH2-Cl B.CH3CHO C.CH2="CHBr" D.CH3CH3
(3)能使酸性高锰酸钾溶液褪色但不能使溴水褪色的是;
A.乙烯 B.乙炔 C.苯 D.乙苯
(4)下列四种有机物分子式都是C4H10O,其中不能被氧化为同碳原子数的醛的是______。
A.① 和② B.② 和③ C.③ 和④ D.① 和④
Ⅲ.由乙烯和其它无机原料合成环状化合物E,其合成过程如下:
⑴写出C的结构简式 。
⑵写出下列转化的化学方程式:
A→B:;
B+D→E:。
(15分)
(1)某肉制品包装上印有相关配料:精选瘦肉、食盐、胭脂红、苯甲酸钠。其中属于调味剂的是,属于着色剂的是,属于防腐剂的是。
(2)亚硝酸钠有毒,其外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
| 性质 |
亚硝酸钠 |
氯化钠 |
| 1.酸性条件下的稳定性 |
微热时分解为NO和NO2 |
微热时不分解 |
| 2.熔点 |
271℃ |
801℃ |
| 3.室温时的溶解度 |
约80g |
约35g |
①请根据表中信息设计一种鉴别NaNO2和NaCl的方法,写出简单的操作过程、现象和结论:
②碘是人体中不可缺少的(选填“常量”或“微量”)元素。
③食盐中加入碘元素能有效防止缺碘引起的疾病。以前在食盐中加入碘化钾(KI),放置一年后,碘流失约92%。现在食盐中加入碘酸钾(KIO3),在相同条件下碘仅损失约7%。食盐中加入碘化钾的碘损失率高的原因是;(填字母)。
a.碘化钾被氧化,造成碘化钾的碘损失率高。
b.碘化钾升华,造成碘化钾的碘损失率高。
c.碘化钾与食物中的成分发生反应,造成碘化钾的碘损失率高。
④萃取碘水中的碘时,一般选用的试剂是(填字母);
A.酒精 B.四氯化碳 C.乙酸
⑤可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾。反应化学方程式为:
5KI+KIO3 + 6HCl ="=" 6KCl + 3I2 + 3H2O,反应的现象是
⑥已知碘酸钾受热易分解,你认为在用碘酸钾加碘盐进行烹饪时应注意什么问题?。
⑶糖类、油脂、蛋白质都是人体必需的营养物质。
①油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和(写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
②氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(—NH2)和(写结构简式)。人体中共有二十多种氨基酸,其中人体自身_____(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
③淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水。写出葡萄糖在体内被氧化的化学方程式:。
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素元素的符号是__________;,其最高正价为_______;
(2)Y元素位于周期表中位置是:________周期________族;
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;