对下列各溶液中,微粒的物质的量浓度关系表述正确的是
| A.0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B.0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D.在25℃100 mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O) |
尿素[CO(NH2)2]可用于电解制氢气,尿素属于
| A.酸 | B.碱 | C.盐 | D.有机物 |
下列物质属于强电解质且能导电的是
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融的NaOH ⑥稀硫酸 ⑦乙酸
| A.⑤ | B.①②⑥ | C.②⑤⑥⑦ | D.①③④⑤⑥ |
下列有关除杂质(括号中为杂质)的操作中,错误的是
| A.福尔马林(甲酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 |
| B.溴乙烷(乙醇):多次加水振荡,分液,弃水层 |
| C.苯(苯酚):加溴水,振荡,过滤除去沉淀 |
| D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
下列实验方法不正确的是
| A.用金属钠可区分乙醇和乙醚 |
| B.用溴水检验汽油中是否含有不饱和脂肪烃 |
| C.用水可区分苯和溴苯 |
| D.用蒸馏的方法可以分离醋酸与乙醇的混合物 |
已知柠檬醛的结构简式为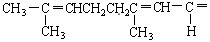 O根据已有知识判定下列说法
O根据已有知识判定下列说法
不正确的是
| A.它可使KMnO4溶液褪色 |
| B.加入FeCl3溶液,能发生显色反应。 |
| C.它可以发生银镜反应 |
| D.它被催化加氢后最终产物的化学式为C10H22O溶液 |