(10分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________。
(2)B为0.1 mol·L-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:________________________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入________,目的是_______________;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为__________________。
(2014届江苏省南通市高三第二次调研化学试卷)
某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示:
⑴粉碎后的铝土矿碱浸时应在高温下进行,其目的是 。
⑵AlO(OH)与NaOH反应的化学方程式为 。
⑶在稀释、结晶过程中:稀释的目的是 ;加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的 气体的方法来代替。
⑷浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式: 。
⑸该生产流程能实现 (填化学式)的循环利用。
(2014届江西省八校高三下学期联考理综化学试卷)
1862年,比利时化学家索尔维发明了氨碱法制碱,1926年,我国化学家侯德榜创立了
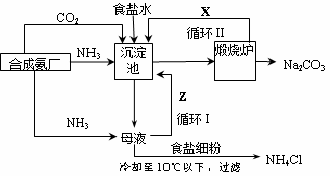
更为进侯德榜制碱法,也叫联合制碱法,两种制碱的生产流程可简要表示如下图: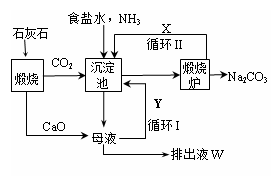
氨碱法生产流程联合制碱法生产流程
(1)向沉淀池中通入CO2和氨气时,应先通入氨气的原因是 。
(2)沉淀池中发生反应的化学反应方程式是 从沉淀池中分离沉淀的操作是 。
(3)氨碱法生产流程示意图中的Y是 ,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 。
(4)联合制碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确是 (选填编号)。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
d.通入氨气能使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(5)联合制碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环Ⅰ,联合制碱法的另一项优点是 。
(6)产品纯碱中含有碳酸氢钠,可以用加热分解的方法测定产品中纯碱的质量分数,已知样品质量为ag,加热至质量不再改变时称重为bg,则纯碱的质量分数为 。
(届内蒙古鄂尔多斯市高三第一次模拟考试理综化学试卷)
鄂尔多斯市已探明煤炭储量1496亿多吨,约占全国总储量的1/6。煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题。
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为和。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为
FeS2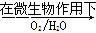 Fe2++SO42-
Fe2++SO42-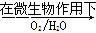 Fe3+
Fe3+
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为,第二步反应的离子方程式为。
(3)工业煤干馏得到的产品有焦炭、。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=,实际生产要将r值维持在1.7~2.2之间,原因是。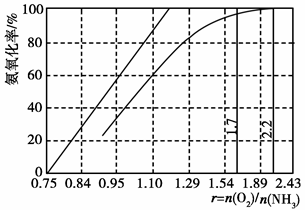
(2014届山东省日照市高三3月模拟考试理综化学试卷)
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下: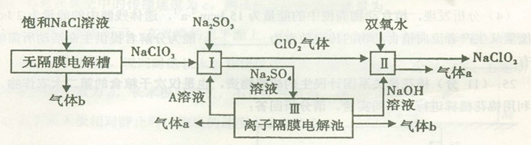
(1)A的化学式是 ,装置III中A在 极区产生。
(2)II中反应的离子方程式是 。
(3)通电电解前,检验III中阴离子的方法和步骤是 。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是 (填字母编号)。
a.Na2O2b.FeCl2c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07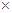 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中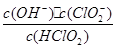 = 。
= 。
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是
(2014届北京市西城区高三4月一模考试理综化学试卷)
以铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)为原料,可制得液体聚合氯化铝Alm(OH)nCl3m-n,生产的部分过程如下图所示(部分产物和操作已略去)。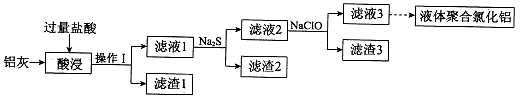
已知某些硫化物的性质如下表:
(1)操作I是 。Al2O3与盐酸反应的离子方程式是 。
(2)滤渣2为黑色,该黑色物质的化学式是 。
(3)向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7。NaClO的作用是 。
(4)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝。反应的化学方程式是 。
(5)将滤液3电解也可以得到液体聚合氯化铝。装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)。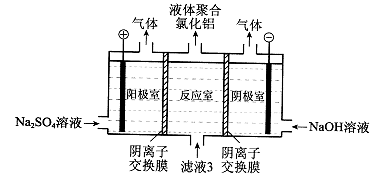
①写出阴极室的电极反应: 。
②简述在反应室中生成聚合氯他铝的原理: 。