现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,其中物质E是气体丙的水溶液,物质H是红褐色沉淀。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出A、C、丙的化学式:
A 、 C 、 丙
(2)写出反应③的化学方程式: ,
反应⑤的离子方程式: 。
将含有少量氯化钾的硝酸钾固体提纯,某学生进行如图所示实验操作。回答下列问题:
(1)将样品置于烧杯中,加入适量的水溶解,同时用玻璃棒搅拌,搅拌的作用是________________________________________________________________________。
(2)向溶液中加入适量的________溶液,使氯化钾转化为沉淀。
(3)将混合液进行过滤,过滤装置和操作如图,指出图中的两处错误:
①________________________________________________________________________;
②________________________________________________________________________。
(4)为了从滤液中得到硝酸钾晶体,可选用的两种方法是:
①________________________________________________________________________;
②________________________________________________________________________。
某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。他们采用了以下操作制备胶体,请将空白处填写完整。
(1)取一个烧杯,加入20 mL蒸馏水,加热至沸腾,然后向烧杯中滴加1 mL~2 mL饱和________溶液,继续煮沸,待__________________后,停止加热。
(2)将制得的胶体放入半透膜制成的袋内,如图所示。放置2 min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察________(填“有”或“无”)丁达尔现象;再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为____________。
(3)将半透膜内的液体倒入U形管中,如图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是____________(填“阴”或“阳”)极附近颜色逐渐变深,其原因是__________________________________。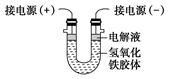
某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物: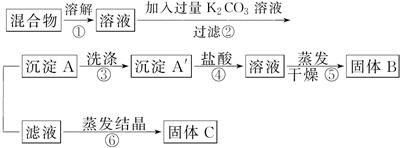
请回答下列问题:
(1)B物质的化学式为____________。
(2)该方案的明显失误是因某一步设计不当而使分离产物不纯,该步正确的方案应是____________。
(3)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是________的质量。
为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是________。
(2)验证氯气的氧化性强于碘的实验现象是________。
(3)B中溶液发生反应的离子方程式是________________________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
________________________________________________________________________。
(5)过程Ⅲ实验的目的是
________________________________________________________________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下________________,得电子能力逐渐减弱。
某实验小组利用纸上层析法分离甲基橙和酚酞,所选的实验用品如下:酚酞、乙醇、浓氨水、饱和Na2CO3溶液、培养皿、滴管、烧杯、量筒、毛细管、小喷壶。步骤:
①在一张圆形滤纸的中心扎一小孔,用少量滤纸捻成细芯,插入圆形滤纸中央。
②在距圆形滤纸中心约1 cm的圆圈上选择三个点,分别用毛细管将甲基橙和酚酞的混合液在该三点处点样,每个点样的直径约0.5 cm。
③把0.1 g甲基橙和0.1 g酚酞溶解在10 mL 60%的乙醇溶液里:取10 mL乙醇和4 mL浓氨水充分混合。
④待黄环半径扩散到滤纸半径的二分之一时,取下滤纸,拔除细纸芯。待滤纸稍干后,喷上饱和的Na2CO3溶液,观察现象。
⑤将滤纸覆盖在盛有乙醇和氨水混合液的培养皿上,使滤纸芯与混合液接触,放置一段时间,点样会逐渐扩散,形成黄环。
根据实验回答下列问题:
(1)该实验小组所选取的实验用品中,缺少的试剂或用品为:________________。
(2)该实验的正确操作顺序为________。
(3)在实验过程中,滤纸起到________的作用。中间的滤纸芯起到的作用是________________。