解释下列操作或事实的离子方程式正确的是
A.把钠投入水中:2Na+2H2O 2Na+ + 2OH-+O2↑ 2Na+ + 2OH-+O2↑ |
B.把铜片放入氯化铁溶液中:Cu +Fe3+ Cu2+ +Fe2+ Cu2+ +Fe2+ |
C.铝制容器不能长期存放碱性食物:2Al + 2OH- 2AlO2-+ H2↑ 2AlO2-+ H2↑ |
D.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2 I2+2H2O I2+2H2O |
某烃含碳、氢元素的质量比为6 : 1,该烃对氮气的相对密度为2,它既可使溴水褪色,又能与氢气加成,而与氢气的加成产物的二氯代物有3种同分异构体。该烃可以是:
| A.H2C |
B.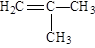 |
| C.H2C |
D. |
某温度和压强下,将4 g由3种炔烃(分子中只含有一个—C≡C—)组成的混合气体与足量的H2反应,充分加成后,生成4.4 g 3种对应的烷烃,则所得的烷烃中一定有:
| A.乙炔 | B.乙烷 | C.丙炔 | D.丙烷 |
某高分子化合物干馏后分解为A,A能使溴水褪色,1 mol A和4 mol H2加成后生成化学式为C8H16的烃,则该高分子化合物是:
A.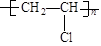 |
B. |
C.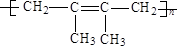 |
D.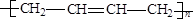 |
下列有关键线式的说法中错误的是:
A.将碳、氢元素符号省略,只表示分子中键的连接情况
B.每个拐点、交点、端点均表示有一个碳原子
C.每一条线段代表一个共价键,每个碳原子有四条线段,用四减去线段数即是氢原子数
D.C=C、C≡C键等官能团中的“=”和“≡”也可以省略
现有某化学式为C3H6O3的有机物,其1H核磁共振谱有三个峰,强度之比为3:2:1,则该有机物的结构简式不可能为:
| A.CH3CH2COOH | B.HCOOCH2CH3 |
| C.CH3COOCH3 | D.CH3COCH2OH |