利用下图所示装置进行实验,能实现实验目的的是(必要时可加热)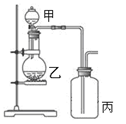
| 选项 |
实验目的 |
甲 |
乙 |
丙 |
| A |
制取并收集NH3 |
浓氨水 |
CaO |
H2O |
| B |
制取并验证C2H2可被KMnO4酸性溶液氧化 |
饱和食盐水 |
电石 |
KMnO4酸性溶液 |
| C |
制取并验证Cl2没有漂白性 |
浓盐酸 |
MnO2 |
干燥的红布条 |
| D |
制取并验证SO2具有漂白性 |
70%硫酸 |
Na2SO3 |
品红试液 |
能正确表示下列反应的离子方程式是
| A.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2 (s)+ 2Fe3+(aq)= 2Fe(OH)3 (s)+ 3Mg2+(aq) |
| B.钠与CuSO4溶液反应:2Na + Cu2+ =" Cu↓" + 2Na+ |
| C.已知:酸的强弱H2CO3>HClO>HCO3-,则:2ClO-+ CO2(少量)+ H2O ===CO32-+ 2HClO |
| D.将足量的NaHCO3溶液加入少量澄清石灰水中:Ca2+ + OH- + HCO3- = CaCO3↓+ H2O |
NA代表阿伏加德罗常数的值。下列叙述正确的是
| A.60 g丙醇中存在的共价键总数为10 NA |
| B.50 mL 18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| C.钠在空气中燃烧可生成多种氧化物。23 g钠充分燃烧时转移电子数为1 NA |
D.235 g核素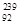 U发生裂变反应: U发生裂变反应: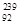 U + U + 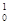 n n 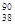 Sr + Sr + 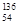 U + 10 U + 10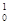 n净产生的中子( n净产生的中子(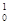 n)数为10 NA n)数为10 NA |
分类是化学学习与研究的常用方法,下列分类正确的是
| A.Na2O、MgO、Al2O3均属于碱性氧化物 |
| B.石灰石、生石灰、熟石灰均属于碱 |
| C.酸、碱、盐之间发生的反应均属于复分解反应 |
D.混合物、分散系、胶体从属关系如图所示 |
已知:将一定量Cl2通入KOH溶液,可能生成KCl、KClO、KClO3,且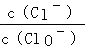 的值与温度高低有关.当n(KOH)="6a" mol时,下列有关说法错误的是
的值与温度高低有关.当n(KOH)="6a" mol时,下列有关说法错误的是
A.若某温度下,反应后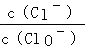 =11,则溶液中 =11,则溶液中 =0.5 =0.5 |
| B.参加反应的氯气的物质的量等于3a mol |
| C.改变温度,反应中转移电子的物质的量ne的范围:3a mol<ne<5a mol |
| D.改变温度,产物中KClO3的最大理论产量为2a mol |
只用下表提供的仪器、试剂,就能达到相应实验目的的是
| 选项 |
仪器 |
试剂 |
相应实验目的 |
| A |
托盘天平(带砝码)、滴管、量筒、烧杯、药匙、玻璃棒 |
食盐,蒸馏水 |
配制500ml一定物质的量浓度的NaCl溶液 |
| B |
烧杯、漏斗、滴管、铁架台(带铁圈)、玻璃棒、滤纸、导气管 |
AlCl3溶液(含少量MgCl2),烧碱,CO2,稀盐酸 |
除去AlCl3溶液中少量的MgCl2 |
| C |
铁架台(带铁圈、铁夹)、分液漏斗、洗气瓶、烧杯、圆底烧瓶、导管(若干)、石棉网 |
MnO2、稀盐酸、浓硫酸、饱和食盐水、氢氧化钠溶液 |
制备干燥纯净的Cl2 |
| D |
分液漏斗、烧瓶、锥形瓶、导管、橡皮塞 |
稀盐酸,大理石,硅酸钠溶液 |
证明非金属性:Cl>C>Si |