铁是当代社会中用量最大的金属之一。磁铁矿是工业上冶炼铁的原料之一,发生的主要反应为:Fe3O4(s)+4CO 3Fe(s)+4CO2
3Fe(s)+4CO2
(1)已知:①Fe3O4(s)+4C(石墨) 3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
②C(石墨)+CO2(g) 2CO(g) ΔH=+172.5 kJ/mol
2CO(g) ΔH=+172.5 kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是 。
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是 (选填字母)。
a.容器内压强不再变化
b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化
d.生成CO2的速率与消耗CO的速率相等
②CO的平衡转化率是 。
③l0 min内,反应的平均反应速率v (CO2)= 。
④欲提高该反应中CO的平衡转化率,可采取的措施是 (选填字母)。
a.提高反应温度 b.移出部分CO2
c.加入合适的催化剂 d.减小容器的容积
⑤T℃时,该反应的平衡常数K= 。
某地的酸雨中,含c (Na+) = 7.0×10-6mol/L,c (Cl-) = 4.5×10-5 mol/L,c (NH4+) = 2.3×10-5 mol/L,c (SO42-) = 2.5×10-6 mol/L,则该地酸雨的pH约为。.
在25℃时,若100体积的某强酸以溶液与1体积的某强碱溶液混合后溶液呈中性,则混和之前,该强酸pH值与强碱pH值之间应满足的关系是的。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: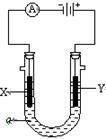
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
a.电解池中X极上的电极反应式为。在X极附近观察到的现象是。
b.Y电极上的电极反应式为,检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
a .X电极的材料是,电极反应式是。
b.Y电极的材料是,电极反应式是。
(说明:杂质发生的电极反应不必写出)
(5分)日常生活中,可用明矾作为净水剂,这是因为:明矾溶于水发生水解反应,生成氢氧化铝胶体。
(1)该反应的离子方程式为:。为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,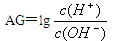 。
。
(2)中性溶液的AG=。
(3)常温下,测得用明矾净化过的净水溶液PH=6,则溶液的 AG=,由水电离的c(H+)=。
在固定容积的密闭容器中,有可逆反应nA(g)+mB(g)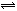 pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值,混合气体的密度;降温时,混合气体的平均相对分子质量;加入催化剂,气体的总物质的量;充入C,则A、B的物质的量。(增大、减小、不变、不确定)
pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值,混合气体的密度;降温时,混合气体的平均相对分子质量;加入催化剂,气体的总物质的量;充入C,则A、B的物质的量。(增大、减小、不变、不确定)