短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示。下列说法正确的是
| A.原子半径的大小顺序: r(W) >r(Z)> r(Y) |
| B.Y、Z的氢化物有可能含非极性键 |
| C.Z、W形成的化合物W显负价 |
| D.Y分别与Z、W形成的化合物全部都是非极性分子 |
在①丙烯 ②氯乙烯 ③苯 ④甲苯四种有机化合物中,分子内所有原子均在同一平面的是( )
| A.①② | B.②③ | C.③④ | D.②④ |
用分液漏斗可以分离的一组混合物是( )
| A.溴和CCl4 | B.苯和溴苯 | C.硝基苯和水 | D.汽油和苯 |
始祖鸟烯(Pterodactyladiene)形状宛如一只展翅飞翔的鸟,其键线式结构表示如下,其中R1、R2为烷烃基。则下列有关始祖鸟烯的说法中正确的是( )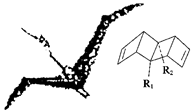
| A.始祖鸟烯与乙烯互为同系物 |
| B.若R1=R2=甲基,则其化学式为C12H16 |
| C.若R1=R2=甲基,则始祖鸟烯的一氯代物有3种 |
| D.始祖鸟烯既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,且两反应的反应类型是相同的 |
甲烷分子中的四个氢原子都可以被取代。甲烷分子的四个氢原子都被乙烯基(CH2===CH—)取代得到的产物的结构如下所示,下列对所得分子的描述中不正确的是( )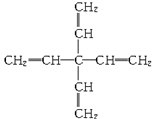
| A.分子式为C9H12 |
| B.1 mol此分子在一定条件最多能与4 mol H2发生反应 |
| C.所有碳原子都在同一平面上 |
| D.此物质属于烯烃类物质 |
一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相等。将1.0体积这种混合气体在氧气中完全燃烧,生成2.0体积的CO2和2.4体积的水蒸气(气体体积均在相同状况下测定),则混合气体中烷烃和烯烃的体积比为( )
| A.3∶1 | B.1∶3 | C.2∶3 | D.3∶2 |