金属材料在生产、生活中的应用非常广泛。
(1)吃火锅用的锅体是由铜合金制造的,主要是因为铜合金具有很好的 (填序号)。
A.导电性 B.导热性 C.延展性
(2)金属锈蚀造成浪费。铁制品锈蚀的过程,实际上是铁与空气中的 和 发生化学反应的过程。
(3)目前世界上已有50%以上的废钢铁得到回收利用,其目的是 。
A.节约金属资源 B.合理开采矿物 C.防止钢铁生锈
(4)金属是一种重要的材料,人类的生活和生产都离不开金属。下表表示了金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发、利用的大致年限。
根据图中数据和有关的化学知识,你认为金属大规模开发、利用的先后顺序跟下列 有关。
①地壳中金属元素的含量;
②金属的导电性;
③金属的活动性;
④金属的延展性;
⑤金属冶炼的难易程度。
(5)实验室有锌片、铁片、铜片、稀硫酸、硫酸锌溶液、硫酸亚铁溶液和硫酸铜溶液7种物质,小红选择合适的物质,设计了以下三种方法对锌、铜、铁的金属活动性顺序进行验证。
①方法一所选用的3种物质是 、硫酸锌溶液和硫酸铜溶液。
②方法二所选用的3种物质是锌片、铜片和 。
③方法三所选用4种物质是锌片、铁片、铜片和 。
(6)炼铁的原理是利用一氧化碳与氧化铁反应,其反应的化学方程式为 。在实验室里,可用下图所示装置进行实验:实验中玻璃管内的粉末由红色色变黑色,红色粉末氧化铁中的铁元素的化合价为 。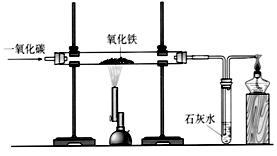
(7)某钢铁厂每天需消耗5 000 t含Fe2O3 80%的赤铁矿石,该厂理论上可日产含Fe 98%的生铁 t。(计算结果保留1位小数)
(8)某兴趣小组的同学对一批铁的样品(含有杂质,杂质不溶与水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中一位同学所用的稀硫酸与铁样品恰好完全反应,实验数据如表:
| |
甲 |
乙 |
丙 |
| 烧杯+稀硫酸的质量 |
200 |
150 |
150 |
| 加入铁的样品的质量 |
9 |
9 |
14 |
| 充分反应后,烧杯+剩余物的质量 |
208、7 |
158、7 |
163、7 |
请你认真分析数据,回答下列问题:
① 同学所用的稀硫酸与铁的样品恰好完全反应?
②计算铁的样品中铁的质量分数。(写出详细的计算过程)
(6分)A是常见金属单质,B、C是非金属单质,且C是密度最小的气体,甲是磁铁矿的主要成分,它们之间有如下的转化关系(部分产物和反应条件未标明)。
(1)推断甲、乙的化学式为:甲,乙;
(2)写出反应③的化学方程式,该反应体现出物质C的
性,在①②③④⑤五个反应中,属于置换反应的有个;
(3)反应①除了具有放出热量多,原料不受限制的优点外,还有的优点。
(1)请用化学用语表示:
①5个钾原子②4个铵根离子③硫酸中硫的化合价为+6价
(2)按要求写出下列反应的化学方程式:
① 稀盐酸除铁锈
② 碳酸钠溶液和石灰水混合
(3)A、B、C三种不含结晶水的固体物质的溶解度曲线如图,回答有关问题。
① t2℃ A、B、C的溶解度大小关系是;
② t1℃ 将20克的A加入到50克水中,所得溶液质量为 克;
③ 将t2℃ A、B、C三种物质的饱和溶液降温至t1℃时,溶液中溶质的质量分数保持不变的是。(选填A、B、C)
化学与我们的生活有紧密联系,请选择下列物质用序号填空。
①Na2CO3②CaO③KNO3④C6H12O6⑤NaOH⑥氧气⑦氮气
(1)人体血糖含量的“糖”是;(2)与水反应放热可以煮鸡蛋的是;
(3)可作复合肥料的是;(4)侯氏联合制碱法的主产品是;
(5) 广泛应用于肥皂、造纸、纺织等工业的碱是 ;
(6)能用于食品防腐的气体是。
A、B、C是初中化学中的常见物质,分别由一种、两种、三种元素组成,A发生化合反应、B发生分解反应、C发生中和反应都能生成水.据此请回答:
(1)写出A生成水的化学方程式;
(2)写出B的化学式;
(3)从化合物的分类上说C属于。
分别选用一种试剂除去下列物质中的杂质(括号内为杂质)。
(1)CO2(水蒸气); (2)NaCl(Na2SO4);
(3) NaOH〔Ca(OH)2〕;