下图是实验室制取、提纯氯气及研究氯气性质的装置图。请回答: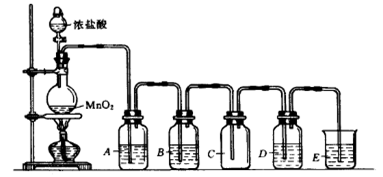
(1)上图实验室制备氯气的化学反应方程式为 。
(2)通常用向上排空气法或者排饱和食盐水法收集氯气,若要利用C瓶收集到干燥纯净的氯气,B瓶所装的试剂是 。(填名称)
(3)若D瓶中装有硝酸银溶液,则观察到的现象是 。
(4)E装置用来 ,写出E装置中发生化学反应的离子方程式 。
(3分)在烧杯或试管里进行固体物质的溶解时,为了加快溶解速度,常采用的方法有___________、_____________、______________等。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以离子的形式存在。实验中从海藻提取碘的流程图如下:
(1)指出提取碘的过程中有关的实验操作名称①写出过程②中有关反应的离子方程式:
(2)提取碘的过程③中可选择的有机试剂为
| A.酒精、四氯化碳 | B.四氯化碳、苯 |
| C.汽油、醋酸 | D.汽油、甘油 |
(3)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
(4)在过程④的操作中发现晶体碘大量附着在烧瓶内壁上,是由于碘具有性质
硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀硫酸的混合物中,加热使之反应完全(装置如图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.
(1)怎样检查图I装置的气密性。
(2)图I中分液漏斗内装的液体是。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是,
,,(可不答满).
(4)课外兴趣小组同学在测定胆矾(CuSO4·χH2O)晶体中结晶水的含量时.测得有关数据如下表:
| 加热前质量 |
加热后质量 |
|
| m1(容器) |
m2(容器+晶体) |
m3(容器+无水CuSO4) |
| 5.4g |
7.9g |
6.8g |
①为完成测定,图Ⅲ中还缺少的仪器名称是。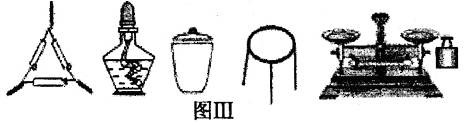
②判断样品已恒重的方法是。
③测定所得胆矾(CuSO4·χH2O)中结晶水含量的实验中,称量操作至少进行次。
④课外兴趣小组的测定结果x值(与CuSO4·5H2O相比)(填“偏高”、“偏低”、“不变”),可能的原因是。(填字母序号)
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝的试剂瓶久置于潮湿空气中,会自动爆炸并产生大量白雾。氯化铝常作为有机合成和石油工业的催化剂,并用于处理润滑油等。工业上由金属铝和氯气作用或由无水氯化氢气体与熔融金属铝作用制得。






某课外兴趣小组在实验室中,通过下图装置制取少量纯净的无水氯化铝。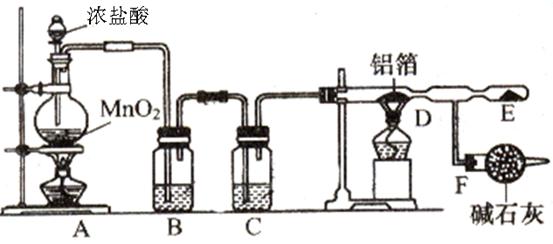
(1)A装置中发生反应的化学方程式为;
(2)B、C装置中应盛放的试剂名称分别为、;
(3)从A装置导出的气体若不经过B、C装置而直接进入D管,将对实验产生的不良后果是;
(4)F装置所起的作用是。
(6分)实验室进行下列实验:①制乙烯②制乙炔③石油分馏④苯的硝化⑤制溴苯⑥制乙酸乙酯
(1)不需要加热的有__________________;
(2)需要水浴的有____________________;
(3)需要用温度计的有_______;其中温度计插入反应液中的有______;
(4)需加催化剂的有__________________;
(5)加入浓H2SO4且起催化剂、脱水剂作用的有________________。