下图为某化工企业生产流程示意图:
下列说法正确的是
| A.钛酸亚铁(FeTiO3)中钛元素为+3价 |
B.①中反应为:2FeTiO3+6C+7Cl2 2X+2TiCl4+6CO,则X为FeCl3 2X+2TiCl4+6CO,则X为FeCl3 |
| C.③中氩气(Ar)作保护气,反应类型为置换反应 |
| D.②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2 |
室温下,称取氯化钠固体和碳酸钠固体各30 g放入同一烧杯中,加入100 g水充分搅拌后静置,得到二者的混合溶液。请参照氯化钠、碳酸钠两物质的溶解度表判断,以下结论不正确的是( )
| 温度/℃ 溶解度/g 物质 |
0 |
10 |
20 |
30 |
40 |
| 氯化钠 |
35 |
35.5 |
36 |
36.5 |
37 |
| 碳酸钠 |
6 |
10 |
18 |
36.5 |
50 |
A.20 ℃时,氯化钠的溶解度大于碳酸钠的溶解度
B.20 ℃时,未溶解固体是氯化钠和碳酸钠的混合物
C.30 ℃时,溶液中氯化钠和碳酸钠的质量分数相同
D.30 ℃时,溶液为氯化钠和碳酸钠的不饱和溶液
配制溶质质量分数为5%的下列溶液,能达到目的的是( )
| A.称取5.0 g氯化钾,溶解在95 mL水中,充分搅拌 |
| B.称取5.0 g氯化钾,放入100 mL水中,充分搅拌 |
| C.量取5.0 mL浓盐酸,倒入95 mL水中,充分搅拌 |
| D.称取5.0 g碳酸钙,放入95 mL水中,充分搅拌 |
如图是甲、乙两种固体的溶解度曲线。下列说法正确的是( )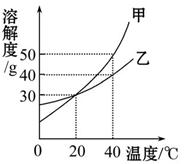
| A.甲的溶解度等于乙的溶解度 |
| B.升高温度可将甲的不饱和溶液变为饱和溶液 |
| C.20 ℃时,100 g乙的饱和溶液中溶质质量是30 g |
| D.40 ℃时,分别用100 g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量 |
蔗糖是生活中常用的调味品,其溶解度曲线如图。下列说法正确的是( )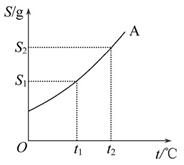
| A.蔗糖在热水中的溶解度比在冷水中的小 |
| B.将蔗糖饱和溶液蒸发溶剂后恢复至原温度,有结晶现象 |
| C.温度升高,溶液中蔗糖的质量分数一定增大 |
| D.t1℃和t2℃时的两份蔗糖溶液,所含溶质的质量不可能相等 |
现有a、b两种物质在t1℃的饱和溶液,将它们的温度分别升高到t2℃,a溶液有晶体析出而b溶液还可以继续溶解一些b晶体。则能表示a、b两种物质的溶解度曲线是( )