下列有关物质的性质与应用的对应关系正确的是
| A.碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污 |
| B.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
| C.铝的熔点很高,可用于制作耐高温材料 |
| D.浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体 |
下列物质仅用物理方法不能鉴别的是
| A.酒精、白醋、香蕉水 |
| B.葡萄糖、淀粉 |
| C.蔗糖、食盐 |
| D.直馏汽油、裂化汽油 |
下列各组溶液,不用其他试剂就能区别开的是
| A.氯化钠 盐酸 偏铝酸钠 氢氧化钠 |
| B.氯化钡 硫酸钠 硝酸钾 硫酸铵 |
| C.盐酸 硝酸 氯化钾 碳酸钠 |
| D.氯化钡 氯化钠 氢氧化钠 硫酸钠 |
关于某无色透明溶液中所含离子的鉴别,下列叙述正确的是
A.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定有 |
| B.通入Cl2后,溶液变为黄色,加入淀粉后溶液变蓝,则原溶液中一定有I- |
C.加盐酸,生成的无色无味气体能使饱和的澄清石灰水变浑浊,则原溶液中一定有 |
| D.加入AgNO3溶液产生白色沉淀,则原溶液中一定含有Cl- |
常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确定的致癌物和致畸形物之一。我国规定:居室空气中甲醛的最高容许浓度为0.08 mg/m3。
某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其他还原性气体):
(1)测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸。
反应的离子方程式为: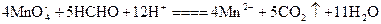
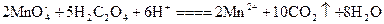
(2)测定装置:部分装置如右图所示(a、b为止水夹)。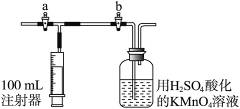
(3)实验步骤:
①检查装置气密性(气密性良好)。
②用__________(填仪器名称)准确移取25.00 mL 1.00×10-3 mol·L-1的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6 mol·L-1 H2SO4溶液备用。
③将2.00×10-3 mol·L-1的草酸标准溶液置于__________(填仪器名称)中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次(共5次)。如果压送气体时速度过快,可能会产生什么不利后果?______________________________。
⑤将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2~3次,并将洗涤液全部转入锥形瓶)。如果没有润洗,所测甲醛的含量将__________(填“偏高”“偏低”或“无影响”)。
⑥用草酸标准溶液滴定锥形瓶中的溶液,并记录滴定所消耗的草酸溶液体积。
本实验是否需要指示剂?(如果需要,请写出指示剂的名称;如果不需要,试说明终点时的实验现象)______________________________。
⑦再重复实验两次。
(4)数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为25.00 mL):
| 装置后 第n天 |
草酸溶液/mL |
甲醛的浓度mg/m3 |
|||
| 1 |
2 |
3 |
平均值 |
||
| 1 |
15.86 |
15.72 |
15.67 |
15.75 |
|
| 7 |
26.17 |
26.36 |
26.38 |
26.30 |
|
| 30 |
30.90 |
30.67 |
30.81 |
30.79 |
设KMnO4溶液的物质的量浓度为c1 mol·L-1,KMnO4溶液的体积为V1 mL;草酸溶液的物质的量浓度为c2 mol·L-1,草酸溶液的平均体积为V2 mL。
则:室内空气中甲醛浓度(mg/m3)的代数式为__________,第30天室内空气中甲醛浓度为__________(精确到小数点后两位),并判断此时主人__________(填“能”或“不能”)入住。
对某无色溶液中所含离子进行鉴别,根据实验事实所得出的相应结论正确的是
| 实验事实 |
结论 |
|
| A |
加入AgNO3溶液生成白色沉淀,加稀盐酸沉淀不消失 |
一定有Cl-存在 |
| B |
通入CO2后溶液中生成白色沉淀,CO2过量沉淀也不消失 |
一定有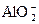 存在 存在 |
| C |
通入Cl2后溶液变为黄色,加入淀粉溶液后溶液变蓝 |
一定有I-存在 |
| D |
加入紫色石蕊试液,溶液变蓝色 |
一定有OH-存在 |