向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:
A(g)+xB(g) 2C(g) ΔH=a kJ·mol-1
2C(g) ΔH=a kJ·mol-1
各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下表和下图:
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5 L |
0.5 L |
1.0 L |
| 温度/℃ |
T1 |
T2 |
T2 |
| 反应物 起始量 |
1.5 mol A 0.5 mol B |
1.5 mol A 0.5 mol B |
6.0 mol A 2.0 mol B |
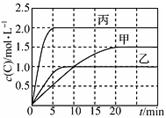
下列说法不正确的是
A.10 min内甲容器中反应的平均速率v(A)=0.10 mol·L-1·min-1
B.其他条件不变,甲容器中在20 min后,降低温度,平衡向正反应方向移动
C.保持其他条件不变,若起始时向乙容器中充入3.0 mol A、1.0 mol B和2.0 mol C,则反应达到新平衡前v(逆)>v(正)
D.T2℃,向丙容器的平衡体系中再充入1.5 mol A、0.5 mol B,平衡时C的体积分数大于25%
下列物质中属于强电解质的是
| A.NH3·H2O | B.H2O | C.CH3COOH | D.醋酸铵 |
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+1/2O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+1/2O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
| A.① | B.④ | C.②③④ | D.①②③ |
将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
Ag2SO4(s)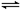 Ag2O(s)+SO3(g),2SO3(g)
Ag2O(s)+SO3(g),2SO3(g)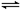 2SO2(g)+O2(g),经十分钟后,反应达到平衡,此时C(SO3)=0.4 mol/L,C(SO2)=0.1 mol/L,则下列叙述不正确的是
2SO2(g)+O2(g),经十分钟后,反应达到平衡,此时C(SO3)=0.4 mol/L,C(SO2)=0.1 mol/L,则下列叙述不正确的是
| A.SO3的分解率为20% | B.平衡时,v(O2)=0.005 mol/(L·min) |
| C.容器内气体的密度为40g/L | D.加压,容器内固体质量不变 |
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?) 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为1:2:2,则下列说法一定正确的是
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为1:2:2,则下列说法一定正确的是
| A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ |
| B.若X、Y不均为气态,到达平衡后若在Ⅰ中再加入1molZ,则新平衡时Y的体积分数变大 |
| C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ |
| D.若X、Y不均为气态,到平衡后若在Ⅱ中再加入2molZ,则新平衡时Z的体积分数变小 |
在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g) H2(g)+I2(g),(正反应吸热)。在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
H2(g)+I2(g),(正反应吸热)。在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是