(15分,除标明外,其余每空2分)由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000°C左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物,该过程中两个主要反应的化学方程式分别是 ,
反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200°C左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是 、 ;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。
用量筒量取一定体积的液体时,若采用俯视的方法量取20 mL液体,则实际量取的液体的体积比20 mL (填大、小、相等。下同),若量筒中实际有20 mL液体,而你读数时采用了俯视的方法,则读得的数据比20 mL 。
下列所含分子数由多到少的排列顺序是 。
| A.标准状况下33.6 L H2 |
| B.所含电子的物质的量为4 mol的H2 |
| C.20 ℃时45 g H2O |
| D.常温下,16 g O2与14 g N2的混合气体 |
E.含原子总数约为1.204×1024的NH3
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。(2)该气体所含原子总数为__________个。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为__ ___。
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为___ __mol/L。
化学试剂应根据其性质和形态进行有效妥善保存:固体试剂应保存在 ,液体试剂保存在 ,见光易分解的试剂(如:浓HNO3、AgNO3等)应用 色试剂瓶保存。氢氟酸(HF)因和玻璃中的SiO2强烈反应而腐蚀玻璃,应用 存放;金属钠、钾应保存在 中;少量白磷应该保存在 中。
(12 分)现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。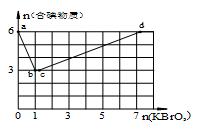
已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;
②2BrO3- +I2 = 2IO3-+ Br2;
请回答下列问题:
(1)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确 (填是或否),并说明理由 。
(2)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(3)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 mol。
(5)n(KBrO3)=4时,对应含碘物质的化学式为 。