【化学一一选修物质结构与性质】X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子。请回答下列问题:
(1)X元素在周期表中的位置是 ,它的外围电子的电子排布图为 。P元素属于 区元素,
(2) 分子的空间构型是 ,
分子的空间构型是 , 分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
(3)含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其因是 。
(4)元素M与元素Q形成晶体结构如图1所示设其晶胞边长为a pm,该化合物的摩尔质量为Dg/mol。求该晶胞密度的计算式为 

(5)三聚氰胺是一种含氮化合物,其结构简式如图2所示。三聚氰胺分子中氮原子轨道杂化类型是 ,1 mol三聚氰胺分子中o键的数目为 。
用天然气合成氨的工艺流程示意如下: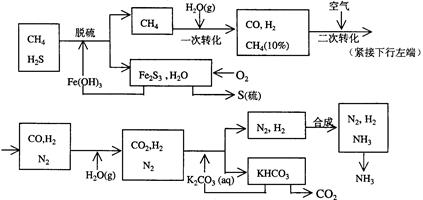
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2mol(用含n的代数式表示)
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是(多选扣分)
(a)相似相溶原理(b)勒沙特列原理(c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于
(写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
美国《科学美国人》杂志在1971年7月刊登的“地球的能量资源”一文中提供了如下数据:
| 直接反射 |
52,000×109 kJ/s |
| 以热能方式离开地球 |
81,000×109 kJ/s |
| 水循环 |
40,000×109 kJ/s |
| 大气流动 |
370×109 kJ/s |
| 光合作用 |
40×109 kJ/s |
到达地球表面的太阳辐射能的几条主要去路:请选用以上数据计算(写出计算过程):
(1)地球对太阳能的利用率约为。
(2)通过光合作用,每年有千焦的太阳能转化为化学能(每年按365天计算)。
(3)设每年由绿色植物通过光合作用(6CO2 + 6H2O → C6H12O6 + 6O2)为我们生存的环境除去二氧化碳的质量为A。试根据能量关系列出A的计算式,列式中缺少的数据用符号表示。
A=(千克),所缺少的数据的化学含义为。
1 mol氢气燃烧时约放热286 kJ,而1 kg汽油燃烧时约放热46000 kJ。请回答:
(1)等质量的氢气和汽油相比,哪种可以放出的热量多?用计算和数据加以说明。
(2)氢气被公认是21世纪替代矿物燃料的理想能源,试简述氢气作为能源的三个主要优点:①;②;③。
已知反应:2H2 + O2 = 2H2O + 能量,请填写下列表格中空白处的总能量值,并注明消耗还是放出。有关键能:H—H:436 kJ/mol O—O:496 kJ/mol H—O:463 kJ/mol
| 拆开化学键 |
形成化学键 |
能量变化 |
| 2 mol H2中的化学键 |
4 mol H—O键 |
4×463 kJ — 2×436 kJ — 496 kJ =" 484" kJ |
| 1 mol O2中的化学键 |
||
铅蓄电池是常见的化学电源之一,其充电、放电的总反应是: 2PbSO4 + 2H2O Pb + PbO2 + 2H2SO4
2PbSO4 + 2H2O Pb + PbO2 + 2H2SO4
(1)铅蓄电池放电时,(填物质名称)在负极发生(氧化、还原)反应。
(2)铅蓄电池充电时,应将蓄电池的负极与电源的极连接。
(3)有一个蓄电池两个电极的极性标志模糊不清了,现提供铜导线和食盐水,请设计一个简单的实验,判断两个电极的极性。写出实验操作、现象和结论。