【化学——选修5:有机化学基础】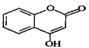 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: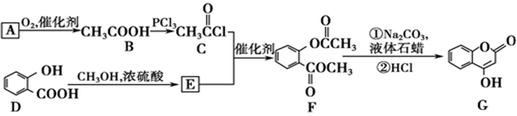
(1)A与银氨溶液反应有银镜生成,写出该反应的离子方程式: 。
(2)B→C的反应类型是: 。
(3)写出D→E的化学方程式: 。
(4)写出F和过量NaOH溶液共热时反应的化学方程式: 。
(5)下列关于G的说法正确的是 。
a.能与溴单质反应
b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应
d.分子式是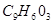
(6)E的同分异构体很多,除E外符合下列条件的共 种。
①含苯环且能与氯化铁溶液显色 ②苯环上有两个取代基 ③含酯基
(7)F分子中有 种不同化学环境的氢原子
【化学——选修5:有机化学基础】(15分)氧氮杂环是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改 善脑缺血等性质。下面是某研究小组提出的一种氧氮杂环类化合物H的合成路线: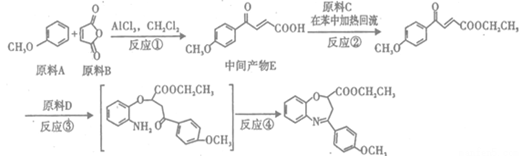
(1)原料A的同分异构体中,含有苯环、且核磁共振氢谱中有4个峰的是(写出其结构简式)。
(2)原料D的结构简式是____________。
(3)反应②的化学方程式是。
(4)原料B俗名“马来酐”,它是马来酸(顺丁烯二酸: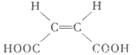 )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( )和聚合物Q:
)和聚合物Q:
①半方酸是原料B的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含 -O-O-键。半方酸的结构简式是____________。
②反应I的反应类型是________。
反应II的化学方程式为____________。
③两分子苹果酸之间能发生酯化反应,生成六元环酯,请写出该反应的方程式。
(15分)有机物H是合成免疫抑制剂药物霉酚酸的中间体,可由如下路径合成得到。
(1)有机物A中的含氧官能团的名称为。
(2)由C转化为D的反应类型为。
(3)反应⑦除了得到有机物H外还得到HBr,试剂X的结构简式为。
(4)步骤⑤可得到副产品有机物J,有机物J和有机物F互为同分异构体,
写出有机物J的结构简式:(任写一种)。
(5)E的一种同分异构体满足下列条件:
Ⅰ.可以发生银镜反应,且能够与NaHCO3反应产生CO2;
Ⅱ.是芳香族化合物,且核磁共振氢谱图显示分子中有4种不同化学环境的氢。
写出该同分异构体的结构简式:。
(6)已知:直接与苯环相连的卤素原子难以与NaOH水溶液发生取代反应。根据已有知识并结合相关信息,写出以 、HCHO为原料制备
、HCHO为原料制备 合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
[化学—选修5:有机化学基础]芳香酯I的合成路线如下:
已知以下信息:
①A—I均为芳香族化合物,B能发生银镜反应,D的相对分子质量比C大4,E的核磁共振氢谱有3组峰。
②
③
请回答下列问题:
(1)A→B的反应类型为,D所含官能团的名称为,E的名称为。
(2)E→F与F→G的顺序能否颠倒(填“能”或“否”),理由 。
(3)B与银氨溶液反应的化学方程式为。
(4)I的结构简式为。
(5)符合下列要求A的同分异构体还有种。
①与Na反应并产生H2②芳香族化合物
(6)根据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
【化学—选修5:有机化学基础】有机化合物X、Y、A、B、C、D、E、F、G之间的转化关系如下图。
已知以下信息:
①RCHO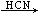
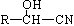


②RCOOH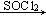

 RCOORˊ(R、Rˊ代表烃基)
RCOORˊ(R、Rˊ代表烃基)
③X在催化剂作用下可与H2反应生成化合物Y。
④化合物F的核磁共振氢谱图中只有一个吸收峰。
回答下列问题:
(1)X的含氧官能团的名称是,X与HCN反应生成A的反应类型是。
(2)酯类化合物B的分子式是C15H14O3,其结构简式是。
(3)X发生银镜反应的化学方程式是。
(4)G在NaOH溶液中发生水解反应的化学方程式是。
(5) 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式。
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式。
(6)写出以C2H5OH为原料合成乳酸(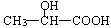 )的路线(其它试剂任选)。
)的路线(其它试剂任选)。
(合成路线常用的表示方式为:A B····
B···· 目标产物)
目标产物)
【化学——选修5:有机化学基础】(15分)合成具有良好生物降解性的有机高分子材料是有机化学研究的重要课题之一。聚醋酸乙烯酯(PVAc)水解生成的聚乙烯醇(PVA),具有良好生物降解性,常用于生产安全玻璃夹层材料PVB。有关合成路线如下图(部分反应条件和产物略去)。
请回答:
(1)A为饱和一元醇,其氧的质量分数约为34.8%,A的化学名称为______,PVA的结构简式为_______。
(2)C中官能团的名称是_________,A~F中核磁共振氢谱出峰最多的是_________(填化合物代号)。
(3)反应③的化学方程式为_________,反应类型是_________;反应④的化学方程式为_________。
(4)PVAc是由F加聚而成,写出两种与F具有相同官能团的同分异构体的结构简式:_________。