硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是
| A.Na+、Fe3+、NO3-、Cl2都可在该物质的溶液中大量共存 |
| B.向0.1mo1/L该物质的溶液中清加0.L/molNaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如上图所示 |
| C.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 |
| D.向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42--完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓ |
实验室中,要使AlCl3溶液中的Al3+全部沉淀出来,最适宜用的试剂是
| A.NaOH溶液 | B.Ba(OH)2溶液 | C.盐酸 | D.氨水 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.5.6g Fe和足量的盐酸反应时,失去的电子数为0.3NA |
| B.1 mol Na2O2固体中含离子总数为4NA |
| C.标准状况下22.4 L氢气和氧气的混合气体所含分子总数为NA |
| D.0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
将足量CO2通入下列各溶液中,所含离子均还能大量存在的是
| A.K+、OH-、Cl- | B.Na+、K+、CO32- |
| C.Na+、HCO3-、SO42- | D.Ba2+、AlO2-、NO3- |
下列离子方程式书写正确的是
| A.醋酸溶液与碳酸氢钠溶液反应:H++HCO3-=H2O+CO2↑ |
| B.铜与稀硝酸反应:Cu+4H++2NO3-=Cu2++NO2↑+2H2O |
| C.氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
| D.硫酸溶液与氢氧化钡溶液反应:H++SO42-+OH-+Ba2+=H2O+BaSO4↓ |
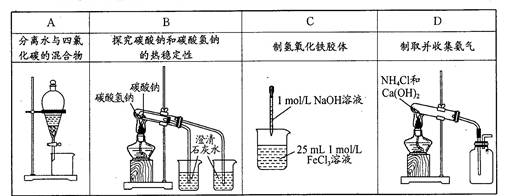
下列实验操作或装置正确的是