短周期主族元素X、Y、Z、W的原子序数依次增大,原子半径r(W)>r(Y)>r(Z)>r(X)。X与W同主族,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是
| A.工业上常用电解的方法制备W的单质 |
| B.元素Z的简单气态氢化物的热稳定性比Y的强 |
| C.仅由X、Y、Z三种元素形成的化合物的水溶液一定呈碱性 |
| D.化合物X2Z2与W2Z2所含化学键类型完全相同 |
我国科学家首次合成了三种新核素,其中一种新核素是 Hf。关于
Hf。关于 Hf,下列说法正确的是:
Hf,下列说法正确的是:

| A.是一种新元素 | B.是一种新原子 |
| C.原子核内有185个质子 | D.原子核外电子数为72 |
在水中加入等物质的量的Ag+、Ba2+、Na+、SO42-、NO3-、Cl-。该溶液放在用惰性材料作电极的电解槽中,通电片刻,则氧化产物和还原产物的质量比为()
| A.35.5∶108 | B.16∶137 | C.8∶1 | D.108∶35.5 |
下列对三种有机物的叙述不正确的是(—SH的性质类似于—OH)( )
)
| A.三种有机物都能发生酯化反应 |
| B.青霉氨基酸不能与盐酸反应,但能与NaOH反应 |
| C.麻黄碱的分子式为C10H15ON,苯环的一氯代物有3种 |
D.阿司匹林能与适量NaOH反应生成可溶性阿司匹林( ) ) |
下列各组离子能在指定溶液中,能大量共存的是( )
①无色溶液中:K+,Cl-,Ca2+,CO32‑,SO42‑,NO3-
②pH=11的溶液中:CO32-,Na+,AlO2‑,NO3‑,S2-,SO32-
③水电离的H+浓度c(H+)=10-12mol·L-1的溶液中:Cl-,CO32-,NO3-,NH4+,SO32-
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
⑤使石蕊变红的溶液中:Fe2+,MnO4-,NO3-,Na+,SO42‑
⑥中性溶液中:Fe3+,Al3+,NO3-,I‑,Cl‑,S2‑
| A.②④ | B.②⑤ | C.①③⑥ | D.①②④ |
在实验室进行下列有关物质的制备中,理论上正确、操作上可行、符合绿色化学思想的是()
A.C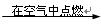 CO CO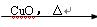 CO2 CO2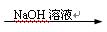 Na2CO3 Na2CO3 |
B.Cu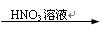 Cu(NO3)2溶液 Cu(NO3)2溶液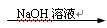 Cu(OH)2 Cu(OH)2 |
C.Fe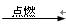 Fe2O3 Fe2O3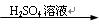 Fe2(SO4)3溶液 Fe2(SO4)3溶液 |
D.CaO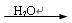 Ca(OH)2溶液 Ca(OH)2溶液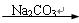 NaOH溶液 NaOH溶液 |