某兴趣小组用修路材料石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他们决定利用该废液,测定Na2CO3溶液中溶质的质量分数。他们将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示。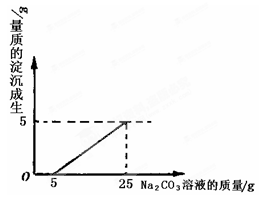
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质除含有CaCl2外,还含有______________________;
(2)计算Na2CO3溶液中溶质的质量分数。(计算结果精确到0.1%)
(3分)标准状况下,用一定量的水吸收氨气后制得浓度为12mol/L、密度为0.915 g/cm3的氨水。试计算1升水吸收多少升的氨气可制得上述氨水。(NH3的相对分子质量以17.0计,水的密度以1.00g/cm3计)(结果保留一位小数)__________
将 和
和 在适宜条件下按下式进行反应
在适宜条件下按下式进行反应

 ,当在某
,当在某 一温度下达到化学平衡状态,试解答:
一温度下达到化学平衡状态,试解答:
(1)若测得平衡混合气体对空气的相对密度为0.6时,求 的转化率.
的转化率.
(2)若测得平衡混合气体对空气的相对密度为0.47时,求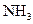 在平衡混合气体中体积分数.
在平衡混合气体中体积分数.
把10.2 g镁铝合金的粉末放入过量的盐酸中,得到11.2 L H2(标准状况下)。试
计算:(原子量:Mg—24、Al—27)
(1)该合金中镁的质量分数。
(2)该合金中镁与铝的物质的量之比。
(3)该合金溶于足量的烧碱溶液中,产生H2的体积(标准状况下)是多少?
实验室常用的浓盐酸物质的量浓度约为12.0mol·L-1。
(1)实验室欲用上述浓盐酸配制480mL 0.20 mol·L—1的稀盐酸溶液,则需要取上述浓盐酸
mL?
(2)配制过程中,不需要的仪器(填写代号)▲。
A.药匙 B.胶头滴管 C.玻璃棒 D.烧杯
完成实验还缺少的仪器是▲。
(3)取用任意体积的所配0.20 mol·L-1 HCl溶液时,下列物理量中不随所取体积的多少而变化的是▲(填字母)
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl—的数目 D.溶液的密度
(4)用15.8g KMnO4氧化足量的上述浓盐酸。反应方程式如下:
2KMnO4 + 16HCl =" 2KCl" + 2Mn Cl 2 + 5Cl 2↑+ 8H2O
Cl 2 + 5Cl 2↑+ 8H2O
则:①有多少摩尔HCl被氧化?
②产生的Cl 2在标准状况下的体积为多少?
某有机化合物A含碳77.8%,氢为7.40%,其余为氧,A的相对分子质量为甲烷的6.75倍。求:
⑴该有机物的分子式。
⑵红外光谱测定,A分子结构中含有苯环和羟基。在常温下A可与浓溴水反应,1molA最多可与2molBr2作用,据此确定该有机物可能的结构简式。