肼(N2H4)又称联氨,可用如下方法制备:CO(NH2)2 + ClO- + OH-— N2H4 + Cl- + CO32- + H2O [CO(NH2)2中N为-3价,方程式未配平],下列说法不正确的是
| A.N2H4是氧化产物 |
| B.N2H4中存在极性键和非极性键 |
| C.配平后,OH-的化学计量数为2 |
| D.生成3.2 g N2H4转移0.1 mol电子 |
一定量碳酸氢钠与过氧化钠的混合物在密闭体系中充分加热后,排出气体,测出固体残留物中有两种成分,则该固体组成中一定含有()
| A.NaHCO3、Na2CO3 | B.NaOH、Na2CO3 |
| C.Na2O2、Na2CO3 | D.Na2O2、NaOH |
下列关于钠与水反应的说法不正确的是()
①将小块钠投入滴有石蕊试液的水中,反应后溶液变红
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后投入水中,两者放出的氢气质量相等
| A.只有①② | B.只有③ | C.只有②③ | D.①②③ |
工业上常用Fe作电极电解处理含Cr2 的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是()
的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是()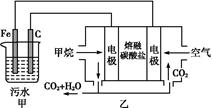
| A.燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96 L |
| B.实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4 |
C.该燃料电池正极的电极反应式为:O2+4e-+2CO2=2C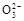 |
D.甲中阳极附近溶液中的离子反应方程式是:Cr2 +6Fe2++14H+=2Cr3++6Fe3++7H2O +6Fe2++14H+=2Cr3++6Fe3++7H2O |
用酸性氢氧燃料电池为电源进行电解的实验装置图如图所示,下列说法中正确的是()
| A.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH- |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
用如图装置,完成很多电化学实验。下列有关此装置的叙述中,不正确的
是()
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |