(13分)A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与 D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同,A与E形成的化合物化学式为AE,其分子中含18 个电子。请回答下列问题:
(1)A元素单质的化学式为 ,D元素的离子结构示意图为_ __。
(2)写出C、D、E最高价氧化物对应水化物的化学式 、 、 (用化学式表示)。
(3)由B元素形成的单质的结构式可表示为 ___。
(4)由A、B、C三种元素形成的化合物的电子式为 ___,这种化合物中所含的化学键类型有 。
(5)比较D、E的气态氢化物与HF的稳定性的由强到弱的顺序为 (用化学式表示)。
(12分)近年来我国汽车拥有量呈较快增长趋势,NOx是汽车尾气中的主要污染物之一。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①写出该反应的热化学方程式,该反应的△S0(填“>”、“<”或“=”);
②根据下图所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数K。
| A.可能增大 |
| B.一定不变 |
| C.可能不变 |
| D.可能减小 |
E.增大、减小、不变均有可能
(2)氮气是合成氨的原料之一,合成氨反应:N2(g)+3H2 (g) 2NH3(g) △H<0,500℃时将1molN2与1molH2充入容积为1L的密闭容器中发生反应,达到平衡后NH3的体积分数为20%。若升高温度至800℃,达到新的平衡时,H2的转化率(填“增大”、“减小”或不变,下同),N2的体积分数。
2NH3(g) △H<0,500℃时将1molN2与1molH2充入容积为1L的密闭容器中发生反应,达到平衡后NH3的体积分数为20%。若升高温度至800℃,达到新的平衡时,H2的转化率(填“增大”、“减小”或不变,下同),N2的体积分数。
(3)在汽车上安装高效催化转化器,将有毒气体转化为无毒气体,可有效降低NOx的排放。某研究性学习小组用气体传感器测得不同时间NO和CO的浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)(×10-4mol·L-1) |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
| c(CO)(×10-3 mol·L-1) |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
请回答下列问题:
①写出反应的化学方程式。
②前2 s内的平均反应速率ν(N2) =。
无机化合物A和金属B是中学化学常见的固体,其中A显淡黄色。相同质量的A、B都能与液体C反应放出气体,两气体又能恰好完全反应生成C。利用B在高温下的挥发性,可通过它的碳酸盐和焦炭在真空环境中来制备B。化合物D可作为有机反应中的脱氢试剂,1molD和1mol NH4Cl反应生成2mol气体E和1molB的氯化物。已知标准状况下气体E的密度为0.76g·L-1。
请回答下列问题:
(1)题中制备B的化学方程式为。
下列物质能替代焦炭的是。
A.NaB.H2C.KMnO4D.Cl2
(2)写出D与过量盐酸反应的化学方程式。
(3)B与E在一定条件下(填“可能”或“不可能”)直接发生反应产生D,判断理由是。
(5分)五种短周期元素A、B、C、D、E,A原子的最外层电子数是次外层的3倍;B是第三周期中除稀有气体外原子半径最大的元素;B和D能形成BD型离子化合物,且B、D的原子核外电子层数相同;C和D能形成CD3的化合物;C原子比E原子多1个电子;1.8 g C与足量的稀H2SO4反应,所产生的氢气在标准状况下的体积为2.24 L;C原子中质子数比中子数少1。则:
(1)元素A在周期表中的位置。
(2)D与E形成的化合物的电子式。
(3)A、B、D简单离子的半径大小关系。(用离子符号表示)
(4)C单质溶于B的最高价氧化物的水化物的离子方程式。
(8分) Q、W、X、Y、Z元素为前四周期元素,且原子序数依次增大,Q元素的阳离子核外无电子,W元素原子的最外层电子数是次外层电子数的2倍,Y是地壳中含量最多的元素,Z的价电子排布式为3d64s2。
(1)Z位于元素周期表第________周期第________族,
(2)W的第一电离能________(填“大于”或“小于”)X的第一电离能。
(3)Z基态原子的价电子排布图为______________________________________,Z的单质与过量的X 的最高价氧化物对应的水化物的稀溶液反应的离子方程式为____________________。
(4)已知:①WQ4(g)+4XY2(g)=4XY(g)+WY2(g)+2Q2Y(g) ΔH=-574 kJ/mol
②WQ4(g)+4XY(g)=2X2(g)+WY2(g)+2Q2Y(g) ΔH=-1 160 kJ/mol
此温度下若用4.48 L(已折算成标准状况下)WQ4还原XY2至X2。整个过程中放出的热量为___kJ。
(8分)钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C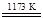 TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg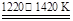 Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的电子排布式为_____________________;
(2)写出与CO互为等电子体的分子__________________;
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
①TiCl4为______化合物(填“离子”或“共价”)(已知电负性:Ti—1.5,Cl—3.0);
②TiCl4分子为正四面体形,则Ti为________杂化;
③配离子[TiCl(H2O)5]2+的中心离子化合价为,中心离子配位数为;
(4)TiCl4在潮湿空气中水解的化学方程式为_____________________________________。