下列实验操作、现象与结论对应关系正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向盛有Fe(NO3)2溶液的试管中加入0.1mol/L H2SO4溶液 |
试管口出现红棕色气体 |
溶液中NO3-被Fe2+还原为NO2 |
| B |
向饱和Na2CO3溶液中通入足量CO2 |
溶液变浑浊 |
析出Na2CO3晶体 |
| C |
等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 |
HX放出的氢气多且反应速率快 |
HX酸性比HY弱 |
| D |
先向2mL0.1mol/LNa2S溶液中滴几滴0.1mol/LZnSO4溶液,再加入几滴0.1mol/LCuSO4溶液 |
开始有白色沉淀生成;后又有黑色沉淀生成 |
Ksp(ZnS)<Ksp(CuS) |
下列各图中,表示正反应是吸热反应的是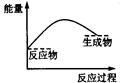

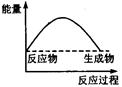
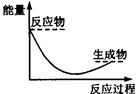
A B C D
 -NMR(核磁共振)可用于含碳化合物的结构分析,
-NMR(核磁共振)可用于含碳化合物的结构分析, 表示的含义错误的是
表示的含义错误的是
| A.表示碳元素的一种同位素 |
| B.表示碳元素的一种核素 |
| C.质量数是13,原子序数是6,核内有7个质子 |
| D.质量数是13,原子序数是6,核内有7个中子 |
下列叙述正确的是:()
| A.光导纤维广泛应用于现代通讯,制造光导纤维的主要原料是硅 |
| B.二氧化碳不宜用于扑灭金属钠燃烧引起的火灾 |
| C.一定条件下,可将石墨转化为金刚石,这一变化是物理变化 |
| D.加碘盐中所加的碘为碘单质 |
结合右图,分析下列叙述中,正确的是
| A.图1所示装置可用于分别制取少量NO和H2 |
| B.图1所示装置可用于验证氧化性:KMnO4>Cl2 |
| C.洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干 |
| D.利用图2所示的方法可以提纯精制氢氧化铁胶体 |
下列与实验相关的叙述中,正确的是
| A.将碘水倒入分液漏斗,再加适量乙醇,充分振荡、静置,可从碘水中萃取碘 |
| B.从CuSO4溶液中结晶得到CuSO4•5H2O的操作是加热浓缩,冷却结晶并过滤 |
| C.酸碱中和滴定时,加入待测液前锥形瓶中有水,测定结果偏低 |
| D.向某溶液中滴加氯水后,滴加KSCN溶液,溶液变红,证明溶液中含有Fe2+ |