用下列装置图进行相应的实验,其中正确的是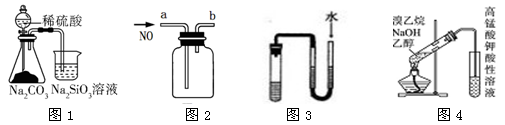
| A.用图1可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图2装置收集一瓶纯净的NO |
| C.用图3装置中U型管两端有液面差且保持不变时证明装置不漏气 |
| D.用图4检验溴乙烷与NaOH的醇溶液共热产生的乙烯 |
关于下列各实验装置的叙述中,正确的是( )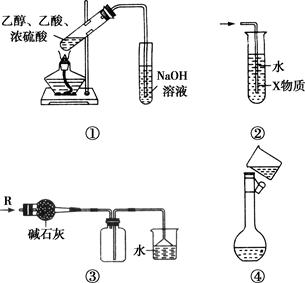
| A.装置①制备乙酸乙酯 |
| B.装置②中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 |
| C.装置③可用于干燥,收集Cl2,并吸收多余的Cl2 |
| D.装置④配制一定物质的量浓度的溶液时转移液体 |
下列实验操作正确的是( )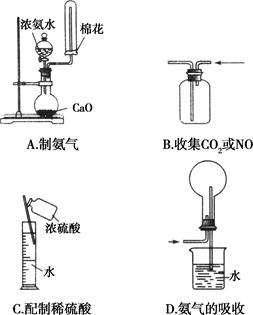
图中装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于( )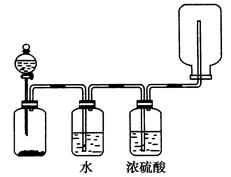
| A.锌和盐酸生成氢气 |
| B.亚硫酸钠和浓硫酸生成二氧化硫 |
| C.碳酸钙和盐酸生成二氧化碳 |
| D.浓氨水和烧碱制取氨气 |
下列制备和收集气体的实验装置合理的是( )
下列制取气体的方案,可以直接采用如图所示装置进行的有( )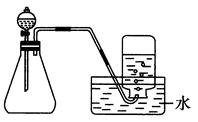
①用H2O2和MnO2制取O2
②用CaCO3和稀盐酸制取CO2
③用KClO3和MnO2制取O2
④用Zn和稀H2SO4制取H2
⑤用Cu和浓HNO3制取NO2
| A.①④ | B.①②④ | C.①②⑤ | D.①②④⑤ |