某溶液中可能含有Na+、K+、AlO2-、CO32-、SO32-、Cl-中的若干种离子。某同学设计并完成了如下实验: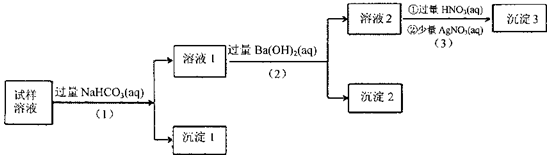
已知:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
根据以上的实验操作与现象,该同学得出的结论不正确的是
| A.沉淀2放置在空气中,若质量增加,试样中肯定存在SO32- |
| B.试样溶液中加人稍过量的NH4C1溶液能得到与沉淀1成分相同的物质 |
| C.上述流程步骤(1)(2)(3)的顺序改为(3)(2)(1),可能会获得相同的实验现象 |
| D.试样溶液中肯定存在AlO2-、Cl-,其中Na+、K+至少存在1种 |
在下列反应中, HCl 作氧化剂的是
| A.NaOH + HCl = NaCl + H2O |
B.MnO2 + 4HCl(浓)  MnCl2 + 2H2O + Cl2↑ MnCl2 + 2H2O + Cl2↑ |
| C.Zn + 2HCl = ZnCl2 + H2↑ |
| D.CuO + 2HCl = CuCl2 + H2O |
根据反应 ① 2FeCl3 + 2KI ═ 2FeCl2 + 2KCl + I2, ② 2FeCl2 + Cl2 = 2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是( )
| A.Fe3+ >Cl2 >I2 | B.Cl2 >I2 >Fe3+ |
C.I2 >Cl2 >Fe3+ | D.Cl2 >Fe3+ >I2 |
下列化学反应中,属于氧化还原反应的是( )
| A.Na2CO3+CaCl2=CaCO3↓+2NaCl | B.Fe+CuSO4=Cu+FeSO4 |
| C.2NaHCO3 =Na2CO3+CO2↑+H2O | D.CaO+H2O=Ca(OH)2 |
欲配制100mL 1.0 mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4溶于100mL水中;② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 mL;③ 将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
| A.①② | B.②③ | C.①③ | D.①②③ |
下列离子方程式正确的是( )
| A.氧化镁与稀盐酸混合: MgO+2H+ =Mg2++H2O |
| B.铁和稀硫酸反应: 2Fe + 6H+ =2Fe3+ + 3H2↑ |
| C.铜片插入硝酸银溶液中:Cu + Ag+ =Cu2+ + Ag |
| D.稀盐酸滴在石灰石上: CaCO3+ 2H+ =Ca2+ +H2CO3 |