下列解释实验事实的化学方程式或离子方程式正确的是
A.用pH试纸检测,氨水溶液呈碱性: NH3·H2O  NH4++OH— NH4++OH— |
B.100 ℃时,测得纯水中c(H+)·c(OH—) =1×10—12:H2O(l) H+(aq)+OH—(aq) H+(aq)+OH—(aq) H<0 H<0 |
C.FeCl3溶液中通入适量SO2,溶液黄色褪去:2Fe3++SO2 +2H2O  2Fe2++SO42—+ 4H+ 2Fe2++SO42—+ 4H+ |
| D.向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O →2C6H5OH+Na2CO3 |
用下列实验装置或操作进行的实验能达到实验目的的是()
A.干燥Cl2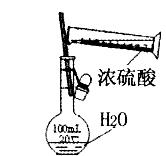 |
B.配制100ml 0.1mol·L-1硫酸溶液  |
C.制取少量蒸馏水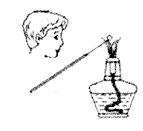 |
| D.检验钾元素的存在 |
元素X的离子结构示意图为 ,元素Y的原子结构示意图为
,元素Y的原子结构示意图为 ,则元素X与元素Y形成的化合物的化学式为()
,则元素X与元素Y形成的化合物的化学式为()
| A.XY | B.X2Y | C.XY2 | D.XY3 |
下列叙述正确的是()
A.摩尔是物质的数量单位 |
B.1mol氧气的质量是32 g·mol-1。 |
| C.CO2的摩尔质量是44g | D.0.5 mol H2SO4中含有2mol氧原子 |
下列关于焰色反应的说法正确的是()
| A.某溶液的焰色反应为黄色,说明该溶液一定含有Na+,不含K+ |
| B.做焰色反应的铂丝,每实验一种样品都需用水洗2—3次 |
| C.没有铂丝,可用光洁无锈的铁丝来代替 |
| D.焰色反应是某些金属离子的性质 |
下列实验操作中正确的是
| A.蒸发操作时,使混合物中的水分完全蒸干后,才停止加热 |
| B.蒸馏操作时,冷凝水应从冷凝管夹层的上口进入 |
| C.进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |