(15分)常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源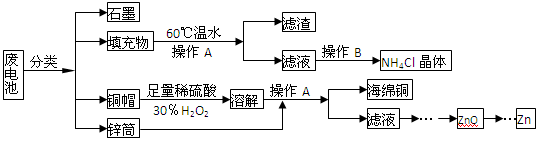
(1)填充物用60 ℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。
铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
A+、B―、C、D四种微粒中均有氢原子,且电子总数均为10个。溶液中的A+和B―在加热时相互反应可转化为C和D。则A+是 ,B―是 ,C是______,D是______。
已知:
反应条件略去):其中R、R/表示原子或原子团。A、B、C、D、E、F、G分别表示一种有机物,G是一种链状烃,它对H2的相对密度为27,E能发生加成反应,而D不能发生加成反应。其转化关系如下图所示(其他反应产物及反应条件略去):
请回答下列问题:
(1) 中官能团名称为。
中官能团名称为。
(2)A反应生成B需要的无机试剂为。
上图所示反应中属于取代反应的共有个。
(3)B和O2反应生成C的化学方程式为。
(4)F的结构简式为。
(5)写出与G互为同分异构体的所有链状烃的结构简式(G除外)、。
1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+、K+、Mg2+、Al3+、NH 、Fe2+、Fe3+ 、Fe2+、Fe3+ |
| 可能大量含有的阴离子 |
Cl-、Br-、I-、CO32-、AlO |
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定不含有的离子是_________。
(2)BC段离子方程式为。
(3)V1、V2、 V3、 V4之间的关系。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的
Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
2.8L |
5.6L |
11.2L |
| n(Cl-) |
1.25mol |
1.5mol |
2mol |
| n(Br-) |
1.5mol |
1.4mol |
0.9mol |
| n(I-) |
a mol |
0 |
0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为___________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________。
现有A、B、C、D四种原子序数依次递增的短周期元素,E是常见的金属元素。已知A的最外层只有一个电子,B的最外层电子数是次外的三倍,C与A的最外层电子数相同,D与B是同主族元素。化合物甲是由A、B、C三种元素组成,化合物乙B、D、E三种元素组成,甲乙两种溶液混合有蓝色沉淀产生。化合物丙和丁都由B、C、D三种元素组成,且丙的相对分子质量比丁大16。请回答下列问题。
(1)画出C的原子结构示意图,指出D在周期表中的位置。
(2)写出丙和丁的化学式,丙,丁。鉴别丙的阴离子的方法是。
(3)写出以Mg、Al为电极材料,以甲为电解质溶液所组成的原电池,负极的电极反应式。
(4)若用石墨为电极,在250C时,电解200mL乙的溶液,当阴极增重6.4g,则反应后溶液的PH=(设反应后溶液的体积仍为200mL);若以铜作电极,电解乙的水溶液,当外电路通过0.2mol电子时,理论上两极质量相差g。
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是天然气的主要成分,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1︰1和l︰2的两种离子化合物。
(1)W在元素周期表中的位置是周期族。
(2)工业合成XQ3是放热反应。下列措施中,既能加快反应速率,又能提高原料利用率是。(填写序号)
| A.升高温度 | B.加入催化剂 | C.将XQ3及时分离出去 | D.增大反应体系的压强 |
(3)2.24 L(标准状况)XQ3被200 mL l mol/L QXY3溶液吸收后,所得溶液中离子浓度从大到小的顺序是。(用离子符号表示)
(4)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如右图所示,a极的电极反应是。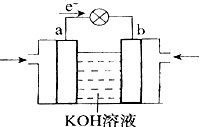
(5)已知:W(s)+Y2(g)=WY2(g);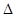 H=-393.5kJ/mol
H=-393.5kJ/mol
WY(g)+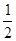 Y2(g)=WY2(g);
Y2(g)=WY2(g); H=-238.0kJ/mol。则 24g W与一定量的Y2反应,放出热量362.5 kJ,所得产物成分及物质的量之比为。
H=-238.0kJ/mol。则 24g W与一定量的Y2反应,放出热量362.5 kJ,所得产物成分及物质的量之比为。
(6)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式为。