【化学—选修5:有机化学基础】(15分)有机物Ⅰ可以用E和H在一定条件下合成:请根据以下信息完成下列问题:
①A为丁醇且核磁共振氢谱有2种不同化学环境的氢;
②
③一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)B的分子式为: 。
(2)C→D、G→H的反应类型为 、 。
(3)芳香族化合物F的分子式为C7H8O, 苯环上的一氯代物只有两种,则F的结构简式为: 。
(4)D生成E的化学方程式为 。
E与H反应生成I的方程式为 。
(5)I的同系物K相对分子质量比I小28。K的结构中能同时满足如下条件:①苯环上只有两个取代基;②分子中不含甲基。共有 种(不考虑立体异构)。试写出上述同分异构体中任意一种消耗NaOH最多的有机物结构简式 。
如图是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色。
(1)若F是由Na+和SO42﹣组成的溶液,则甲的化学式是 ,列举A物质的一种用途 。
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为 ,丁属于单质、酸、碱中的 ;在I溶液中加入氢氧化钠溶液,可以观察到的现象是 ,对应的离子方程式和化学方程式依次是 。
(3)写出G→A+C的化学方程式: 。
(4)写出E和C反应的方程式并用单线桥法标明电子的转移方向和数目: 。
(5)若A中混有杂质Al2O3,除去杂质的方法是加入过量的NaOH溶液,该反应的离子方程式为。
(6)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1.则反应物中A、E、H2SO4的物质的量之比为 。
现有A、B、C、D、E、F、G、H、I九种物质,其中A、B、C均为氧化物,且A为淡黄色粉末,I、E为气体单质,它们之间相互关系如图,其他与题无关的生成物均已略去。请回答下列问题:
(1)写出化学式:
A ,G ,H 。
(2)写出下列反应的离子方程式“
A+B → D+E
F+Ca(OH)2→ D
D+I→ G
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。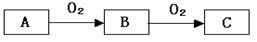
(1)若A是一种黄色单质固体,则B→C的化学方程式为 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为 。将C长期露置于空气中,最后将变成物质D。现有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38 g,D的质量分数为 。
(3)若C是红棕色气体,A可能是一种能用下图装置制取的气体,请结合所学知识,回答下列问题:
①写出实验室制取A的化学方程式 。
②收集A的方法是 ,验证A是否已经收集满的方法是:
(任写一种)。
③若有5.35g氯化铵参加反应,则产生的A气体在标准状况下的体积为 L。
现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,其中A在常温下能与水发生剧烈反应,B是目前使用最多的金属。物质之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙 ; F ;
(2)写出下列反应的离子方程式:
①金属A和水反应的离子方程式 。
②D和G的水溶液反应的离子方程式 。
(3)将G浓溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在 之间,验证的简单方法是: 。
如图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,B为液体,C能使湿润的红色石蕊试纸变蓝,由X受热分解生成的A、B、C的物质的量之比为1:1:1.
(1)写出下列各物质的化学式:D:______;F: 。
(2)写出X分解为A、B、C的化学方程式 。
(3)写出G→E变化的离子方程式 。