下列溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1某二元弱酸的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
B.某酸式盐NaHY的水溶液显碱性,该酸式盐溶液中离子浓度关系为:c(Na+)>c(HY-)>c (OH-)>c(H+)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)
D.25 ℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
下列关于乙酸的说法不正确的是
| A.食醋中含有3%~5%的乙酸 |
| B.黄酒变酸是因为部分乙醇氧化为乙酸 |
| C.与甲酸甲酯互为同分异构体 |
| D.通过乙酸乙酯的碱性水解直接获取 |
将足量的CO2通入下列溶液中,最终溶液浑浊的是
①饱和苏打溶液 ②水玻璃 ③氯化钡 ④次氯酸钙
| A.①② | B.③④ | C.②③ | D.①②③④ |
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。下列说法不正确的
A.a点的溶液呈酸性的原因为:NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
| B.c点沉淀的质量比a点沉淀的质量大 |
| C.b点加入Ba(OH)2溶液的体积为150 mL |
| D.至c点完成反应,反应的离子方程式可表示为: |
Al3++2SO42-+NH4++2Ba2++5OH-= AlO2-+2BaSO4↓+NH3·H2O+2H2O
常温下,用 0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示。下列说法不正确的是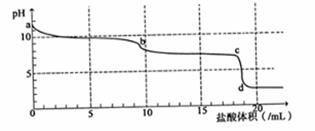
| A.a点时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) |
| B.当盐酸加入5mL时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) |
| C.当盐酸加入10mL时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| D.b-c段发生的反应为:HCO3-+H+= CO2↑+H2O |
为了探索外界条件对反应2NO2(g) N2O4(g) ΔH=- 57 kJ·mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如下图所示。下列说法正确的是
N2O4(g) ΔH=- 57 kJ·mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如下图所示。下列说法正确的是
| A.a、c两点气体的平均相对分子质量:a>c |
| B.a、c两点气体的颜色:a浅,c深 |
| C.b、c两点的平衡常数:Kb=Kc |
| D.状态a通过升高温度可变成状态b |