某温度T1时,向容积为2 L的恒容密闭容器中充入一定量的H2和I2(g),发生反应:H2(g)+I2(g) 2HI(g)反应过程中测定的部分数据见下表(表中t2>t1):
2HI(g)反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min |
n(H2)/mol |
n(I2)/mol |
| 0 |
0.9 |
0.3 |
| t1 |
0.8 |
|
| t2 |
|
0.2 |
下列说法正确的是
A.反应在t1 min内的平均速率为:v(H2)=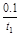 mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,向平衡体系中再通入0.20 mol H2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变
C.保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时n(HI)=0.2 mol
D.升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应
将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是()
①使煤充分燃烧,提高煤的利用率 ②减少SO2的产生,避免造成“酸雨” ③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
| A.①②③ | B.②③④ | C.①③④ | D.①②③④ |
下列说法中不正确的是()
| A.与煤、石油相比较,天然气是一种比较清洁的化石燃料 |
| B.乙醇是一种可再生能源,作为燃料的优点是完全燃烧的产物不污染环境 |
| C.利用太阳能、风能和氢能等能源替代化石能源能有效改善空气质量 |
| D.煤转化为水煤气再燃烧放出的热量不会增加,因此煤的气化毫无意义 |
煤是重要的能源和化工原料,直接燃烧既浪费资源又污染环境。最近,某企业利用“煤粉加压气化制备合成气新技术”,让煤变成合成气(一氧化碳及氢气总含量≥90%),把煤“吃干榨尽”。下列有关说法正确的是()
①煤粉加压气化制备合成气过程涉及化学变化和物理变化
②煤粉加压气化制备合成气过程涉及化学变化但没有物理变化
③该技术实现了煤的清洁利用
④该技术实现了煤的高效利用
| A.①②③ | B.①②④ |
| C.①③④ | D.②③④ |
下列反应不符合绿色化学基本原则的是()
| A.除硫酸厂尾气:SO2+2NH3+H2O=(NH4)2SO3 |
| B.消除硝酸工业尾气氮氧化物的污染:2NaOH+NO2+NO=2NaNO2+H2O |
C.制备CuSO4:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O |
D.制备CuSO4:2Cu+O2 2CuO,CuO+H2SO4(稀)=CuSO4+H2O 2CuO,CuO+H2SO4(稀)=CuSO4+H2O |
在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是()
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥消去反应 ⑦加聚反应 ⑧缩聚反应
| A.①②⑤ | B.②⑤⑦ | C.⑦⑧ | D.⑦ |