下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。

已知:①Fe3+ 、Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要的主要玻璃仪器有______________。
(2)氧化步骤中发生的离子反应方程式有____________________________________
和H3AsO4+Fe3+=FeAsO4↓+3H+。
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol/L。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I的程序依次为 、 、过滤、干燥。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式 。
A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。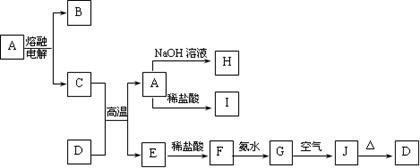
请回答下列问题:
(1)A的化学式为。
(2)H与I溶液混合后,发生反应的离子方程式是。
G→J的化学方程式为。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性原因。
(4) 实验证明,硝酸发生氧化还原反应时,硝酸越稀对应还原产物中氮元素的化合价越低。某同学取一定量的C、E合金与一定量的很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入一定浓度的氢氧化钠溶液,所加氢氧化钠的物质的量与产生的沉淀的物质的量(mol)的关系如左图所示。试回答下列问题: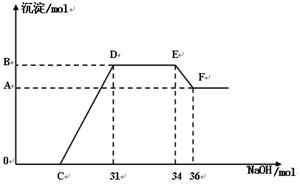
①图中OC段没有沉淀生成,此阶段发生的离子方程式为:_______________________________。
②在DE段没有沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:_________________________________;
③B点对应的沉淀量为________________ mol,C点对应的横坐标为___________mol。
有一白色固体混合物,可能含有K+、Ba2+、Ag+、Mg2+、NH4+、Na+、SO42-、SO32-、CO32-、AlO2--等10种离子中的几种。为了鉴定其中的离子,现进行如下实验,根据实验现象,填写下列空格:
(1)取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12。据此可以排除的离子有;
(2)向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。可以判断肯定存在的离子有;可以排除的离子有,排除的依据是。
(3)不能确定的阳离子有,简述检验的方法(操作、现象、结论)。
原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)1mol Y2X2含有σ键的数目为。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是。
(4)元素W的一种氯化物晶体的晶胞结构如图13所示,该氯化物的化学式是。
T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增。已知:
①W的原子序数为29,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤在该元素所在周期中,Q的基态原子的第一电离能最小;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Q三种元素的电负性由大到小的顺序是(用元素符号表示)。
(2)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是 。
(3)W的基态原子的核外电子排布式为 。
(4)T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,1molM分子中σ键和π键的个数比为。
(5)X与Y原子结合形成的X3Y4晶体,其晶体结构与金刚石类似,但硬度比金刚石大,请解释原因是。
(10)(1)氯碱工业是利用电解食盐水生产①为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、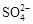 等杂质离子,下列加入顺序合理的是②。
等杂质离子,下列加入顺序合理的是②。
| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 |
NaCl |
Mg(OH)2 |
CaCO3 |
BaSO4 |
其他不溶于酸的物质 |
| 质量分数(%) |
15~20 |
15~20 |
5~10 |
30~40 |
10~15 |
为生产七水硫酸镁,设计了以下工艺流程: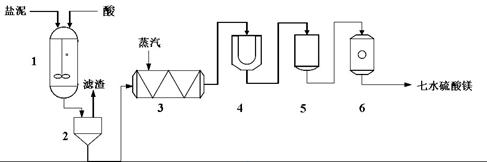
生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用③,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是④。
装置2中滤渣的主要成分为⑤。
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是__⑥__。
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是⑦。