电化学方法是工业上常采用的一种污水处理方法。某含氮废水中含有NO3-,其降解的原理如图所示: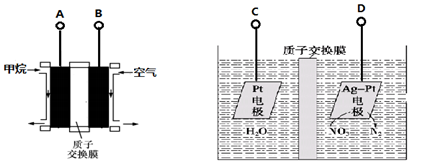
下列说法中不正确的是
| A.燃料电池的A极连接电解池的D级 |
| B.A电极的电极反应式为:CH4-8e-+2H2O = CO2+8H+ |
| C.燃料电池工作时H+移向左边 |
| D.每消耗标况下5.6 L甲烷,则电解池交换膜两侧电解液的质量变化差(Δm左—Δm右)为14.4g |
在NaHCO3溶液中,若采取措施使溶液pH增大的同时,c(CO32-)的变化情况是
| A.增大 | B.减小 |
| C.不变 | D.可能增大,也可能减小 |
对于常温下pH=11的氨水溶液,下列说法中正确的是
| A.加水稀释100倍,9<pH<11 |
| B.加入少量NH4Cl固体,溶液的pH升高 |
| C.加水稀释后c(OH-)/c(NH3·H2O)值将减小 |
| D.完全中和等浓度等体积的盐酸,耗氨水的体积比pH=11的NaOH溶液大 |
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,某些反应与平衡常数数值如下:2NO(g) N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
下列说法中正确的是
| A.常温下,水分解产生O2,此时平衡常数的值约为5×10-80 |
| B.常温下,最易分解放出O2的是水 |
C.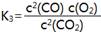 |
| D.以上都不正确 |
在室温下的某密闭容器中,将某气态烷烃与适量氧气混合,点火使之恰好完全燃烧后,冷却到室温,容器中压强为反应前压强的1/2,该气态烃是
| A.甲烷 | B.乙烷 | C.丙烷 | D.丁烷 |
一定条件下,分别对反应A(s)+B(g) 2C(g) (正反应吸热)进行如下操作(只改变该条件):
2C(g) (正反应吸热)进行如下操作(只改变该条件):
①增大A的用量 ②缩小容器的容积 ③升高体系温度 ④减小体系中C的量
上述措施中一定能使正反应速率加快的是
| A.①③ | B.②③ | C.①②③ | D.①②③④ |