石油的裂解是石油化工的重要方法之一,石油的裂解产物是合成材料的重要的基础原料。例如工业上以丙烯为原料可制得一种重要合成橡胶IR和一种合成树脂X。
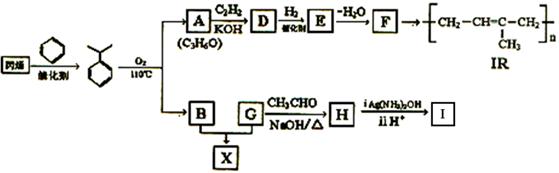
B的分子式是C6H6O,可与NaOH溶液反应;E、F中均含有碳碳双键;H结构简式为 。
。
已知以下信息:
Ⅰ.同一碳原子上有两个碳碳双键时分子不稳定。
Ⅱ.
Ⅲ.
(—R 、 — R'、—R"表示可能相同或可能不同的原子或原子团)
请回答下列问题:
(1)F的系统命名法名称是 。
(2)请写出E的结构简式_________________________。
(3)H的官能团检验顺序为:_________________________。
(4)A与C2H2合成D的化学方程式是 ,反应类型是 。
(5)下列有关上述化合物的说法正确的是 。
①在一定条件下,丙烯可与H2O, NaOH溶液,Br2的CC14溶液,酸性KMnO4溶液等反应
②D和E与足量H2加成后官能团都相同
③1mol A和B以任意比例混合,完全燃烧后产生3mol水
④1 mol D最多能消耗2molNaOH
(6)B与G在一定条件下反应生成合成树脂X的化学方程式是 。
(7)I有多种同分异构体,写出符合下列要求的所有同分异构体的结构简式 。
①与FeCl3溶液反应显紫色;
②只能发生银境反应,不能发生水解反应;
③核磁共振氢谱中只出现四组峰。
(10 分)用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) Si3N4(s) + 12HCl(g)△H<0
Si3N4(s) + 12HCl(g)△H<0
(1)在一定温度下进行上述反应,若反应容器的容积为2L,3min后达到平衡,测得固体的质量增加了1.40g,则SiCl4的平均反应速率为;该反应的平衡常数表达式为。
(2)上述反应达到平衡后,下列说法正确的是
a.其他条件不变,温度升高,平衡常数K减小
b.其他条件不变,压强增大,平衡向正反应方向移动
c.其他条件不变,增大SiCl4物质的量,平衡向正反应方向移动
d.其他条件不变,增大Si3N4物质的量,平衡向逆反应方向移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是
a.v逆(N2)=3v正(H2) b.v正(HCl)=4v逆(SiCl4)
c.混合气体密度保持不变d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为m/n,保持其他条件不变,降低温度后达到新德平衡时,H2和HCl的物质的量之比m/n(填“>”“=”或“<”)
(10分,每空2分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
有关离子完全沉淀的pH如下表:
(1)写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式________________________________________________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ca(OH)2 C.Ba(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14 B.10~11 C.6~8 D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式,并简要写出能生成Ag2CrO4沉淀原因的计算过程。
(10分,每空2分)现有浓度均为0.1 mol/L的下列溶液:①醋酸、②硫酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦硫酸铵,⑧氨水,请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由小到大的顺序是(填序号)__________________。
(2)④⑤⑥⑦⑧五种溶液中NH4+浓度由小到大的顺序是(填序号)__________________ 。
(3)将③和④等体积混合后,混合液中各离子浓度由小到大的顺序是__________________。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)__________________25℃。在t℃时将pH=2的H2SO4的溶液a L与pH=11的NaOH溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=___________ 。
(12分,每空2分)一定的条件下,在某一容积为2L的密闭容器内,物质A、B、C发生某种放热化学反应,反应中物质A、B、C的浓度随时间变化情况如图1:
(1)该反应化学方程式为_____________________________________,该反应的逆反应化学平衡常数表达式为___________;
(2)根据图1数据,反应开始至达到平衡时,平均速率v(C)为________________;
(3)反应达到平衡后,第8分钟时:
①若升高温度,C浓度的变化正确________;(用图2中a~f的编号回答)
②若加入B,该反应的平衡常数将____________。(填“增大”或“不变”或“减小”)
(4)反应达到平衡后,第8分钟时,若反应容器的容积扩大一倍,请在图3中用“粗线条”画出8分钟后C浓度的变化情况。
(6分,每空3分)完成下列填空:
(1)2g碳与适量水蒸气反应生成CO和H2,需吸收21.80kJ热量,此反应的热化学方程式为________________________________________。
(2)已知 CH4(g)+2O2(g)="=" CO2(g)+2H2O(l);ΔH=-Q1kJ·mol-1 ,
2H2(g)+ O2(g) =2H2O(g);△H2=-Q2 kJ·mol-1,
2H2(g)+ O2(g) =2H2O(l);△H2=-Q3 kJ·mol-1。
常温下,取体积比3∶2的甲烷和氢气的混合气体22.4L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为_________________。